题目内容
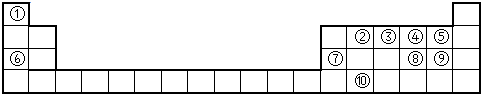
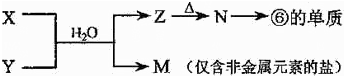 下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,用化学用语回答下列问题:
下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,用化学用语回答下列问题:
| 族 周期 | IA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
(2)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是______.
(3)①、④、⑤、⑧中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式:______.
(4)⑥的单质与⑤的最高价氧化物的水化物发生反应的化学方程式:______.
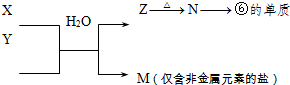
(5)由表中元素形成的常见物质X、Y、Z、M、N可发生以下反应:X溶液与Y溶液反应的离子方程式为______.
解:根据元素在周期表中的分布,可以知道①是H,②是C,③是N,④是O,⑤是Na,⑥是Al,⑦是Si,⑧是Cl
(1)电子层越多半径越大,所以Na、Al>O,电子层一样多的原子,核电荷数越多半径越小,即Na>Al,故答案为:Na>Al>O;
(2)②③是C、N,是同一周期元素的原子,根据元素周期律:从左到右最高价氧化物对应水化物的酸性逐渐增强,所以酸性:HNO3>H2CO3,②⑦是C、Si,是同主族元素,根据元素周期律:从上到下最高价氧化物对应水化物的酸性逐渐减弱,H2CO3>H2SiO3故答案为:HNO3>H2CO3>H2SiO3;
(3)①④⑤⑧分别是H、O、Na、Cl,其中钠元素、氧原子、氢元素组成的氢氧化钠,钠元素、氧原子、氯元素组成的次氯酸钠,均是既含离子键又含极性共价键的化合物,电子式为:,Na+ ,
,
故答案为:Na+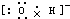 ;
;
(4)⑥的单质Al与⑤Na的最高价氧化物的水化物NaOH发生反应生成偏铝酸钠和氢气,化学方程式为:2Al+2NaOH+2H2O=2NaOH+3H2↑,故答案为:2Al+2NaOH+2H2O=2NaOH+3H2↑;
(5)由表中元素形成的常见物质X、Y、Z、M、N可发生如图转化的反应,其中M是仅含非金属的盐,所以一定是铵盐;Z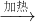 N→⑥的单质.根据周期表的结构判断⑥是金属铝,所以推断N是氧化铝电解生成金属铝,Z是氢氧化铝受热分解生成氧化铝,分析产物结合反应:X+Y+H2O→Al(OH)3+NH4+ 可知XY是铝盐和一水合氨的反应;所以X溶液与Y溶液反应的离子方程式为:
N→⑥的单质.根据周期表的结构判断⑥是金属铝,所以推断N是氧化铝电解生成金属铝,Z是氢氧化铝受热分解生成氧化铝,分析产物结合反应:X+Y+H2O→Al(OH)3+NH4+ 可知XY是铝盐和一水合氨的反应;所以X溶液与Y溶液反应的离子方程式为:
Al3++3NH3+3H2O=Al(OH)3↓+3NH4+;故答案为:Al3++3NH3+3H2O=Al(OH)3↓+3NH4+;
分析:(1)电子层越多半径越大,电子层一样多的原子,核电荷数越多半径越小;
(2)同一周期元素的原子,从左到右最高价氧化物对应水化物的酸性逐渐增强;
(3)过氧化钠是既含离子键又含共价键的化合物;
(4)金属铝具有两性既可以和强酸反应也可以和强碱反应;
(5)M是仅含非金属的盐所以一定是铵盐;Z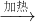 N→⑥的单质.根据周期表的结构判断⑥是金属铝,所以推断N是氧化铝,Z是氢氧化铝,分析产物结合反应:X+Y+H2O→Al(OH)3+NH4+ 可知XY是铝盐和一水合氨的反应;
N→⑥的单质.根据周期表的结构判断⑥是金属铝,所以推断N是氧化铝,Z是氢氧化铝,分析产物结合反应:X+Y+H2O→Al(OH)3+NH4+ 可知XY是铝盐和一水合氨的反应;
点评:本题考查了元素周期表的结构、元素位置、规律变化的应用,主要依托常见元素及其化合物,分析比较原子半径大小,同周期同主族性质递变的应用,化学键的形成和存在,利用铝及其化合物的化学性质,金属铝的制备等知识推断物质.
(1)电子层越多半径越大,所以Na、Al>O,电子层一样多的原子,核电荷数越多半径越小,即Na>Al,故答案为:Na>Al>O;
(2)②③是C、N,是同一周期元素的原子,根据元素周期律:从左到右最高价氧化物对应水化物的酸性逐渐增强,所以酸性:HNO3>H2CO3,②⑦是C、Si,是同主族元素,根据元素周期律:从上到下最高价氧化物对应水化物的酸性逐渐减弱,H2CO3>H2SiO3故答案为:HNO3>H2CO3>H2SiO3;
(3)①④⑤⑧分别是H、O、Na、Cl,其中钠元素、氧原子、氢元素组成的氢氧化钠,钠元素、氧原子、氯元素组成的次氯酸钠,均是既含离子键又含极性共价键的化合物,电子式为:,Na+
 ,
,故答案为:Na+
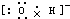 ;
;(4)⑥的单质Al与⑤Na的最高价氧化物的水化物NaOH发生反应生成偏铝酸钠和氢气,化学方程式为:2Al+2NaOH+2H2O=2NaOH+3H2↑,故答案为:2Al+2NaOH+2H2O=2NaOH+3H2↑;
(5)由表中元素形成的常见物质X、Y、Z、M、N可发生如图转化的反应,其中M是仅含非金属的盐,所以一定是铵盐;Z
 N→⑥的单质.根据周期表的结构判断⑥是金属铝,所以推断N是氧化铝电解生成金属铝,Z是氢氧化铝受热分解生成氧化铝,分析产物结合反应:X+Y+H2O→Al(OH)3+NH4+ 可知XY是铝盐和一水合氨的反应;所以X溶液与Y溶液反应的离子方程式为:
N→⑥的单质.根据周期表的结构判断⑥是金属铝,所以推断N是氧化铝电解生成金属铝,Z是氢氧化铝受热分解生成氧化铝,分析产物结合反应:X+Y+H2O→Al(OH)3+NH4+ 可知XY是铝盐和一水合氨的反应;所以X溶液与Y溶液反应的离子方程式为:Al3++3NH3+3H2O=Al(OH)3↓+3NH4+;故答案为:Al3++3NH3+3H2O=Al(OH)3↓+3NH4+;
分析:(1)电子层越多半径越大,电子层一样多的原子,核电荷数越多半径越小;
(2)同一周期元素的原子,从左到右最高价氧化物对应水化物的酸性逐渐增强;
(3)过氧化钠是既含离子键又含共价键的化合物;
(4)金属铝具有两性既可以和强酸反应也可以和强碱反应;
(5)M是仅含非金属的盐所以一定是铵盐;Z
 N→⑥的单质.根据周期表的结构判断⑥是金属铝,所以推断N是氧化铝,Z是氢氧化铝,分析产物结合反应:X+Y+H2O→Al(OH)3+NH4+ 可知XY是铝盐和一水合氨的反应;
N→⑥的单质.根据周期表的结构判断⑥是金属铝,所以推断N是氧化铝,Z是氢氧化铝,分析产物结合反应:X+Y+H2O→Al(OH)3+NH4+ 可知XY是铝盐和一水合氨的反应;点评:本题考查了元素周期表的结构、元素位置、规律变化的应用,主要依托常见元素及其化合物,分析比较原子半径大小,同周期同主族性质递变的应用,化学键的形成和存在,利用铝及其化合物的化学性质,金属铝的制备等知识推断物质.

练习册系列答案
 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案
相关题目



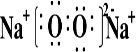










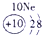






 表示的是
表示的是