题目内容
【题目】根据元素在元素周期表中位置可预测其原子结构,而物质的组成和结构亦可决定物质的性质.
(1)用元素符号表示下列微粒![]()
![]()
![]()
![]()
,,,
(2)依据原子结构与元素周期律知识,下列排序正确的是(填字母序号).
A.微粒半径:r(Al3+)<r(Mg2+)<r(Na+)<r(F)<r(O2)
B.物质酸性:H3AlO3<H4SiO4<H3PO4<H2SO4<HClO4
C.熔点高低:Li>Na>K>Rb>Cs
D.与氢气化合容易程度:F2>Cl2>Br2>I2>N2
(3)有X、Y、Z、W四种元素,已知Y和X形成的化合物YX中,X的化合价为﹣1,Y和Z形成化合物Y2Z,X、Y、Z离子的核外电子总数都是18,W的+1价离子就是质子.
①分别写出下列物质的电子式:YX;W2Z .
②写出X单质与Y的最高价氧化物对应的水化物常温下反应的化学方程式: .
【答案】
(1)O2﹣;F﹣;Na+;Mg
(2)A,B,C,D
(3)![]() ;
;![]() ;Cl2+2KOH=KCl+KClO+H2O
;Cl2+2KOH=KCl+KClO+H2O
【解析】解:(1) ![]() 该微粒含有8个质子和10个电子,为O2﹣;
该微粒含有8个质子和10个电子,为O2﹣; ![]() 该微粒含有9个质子和10个电子,为F﹣;
该微粒含有9个质子和10个电子,为F﹣; ![]() 该微粒含有11个质子和10个电子,为Na+;
该微粒含有11个质子和10个电子,为Na+; ![]() 该微粒含有12个质子和12个电子,为Mg;所以答案是:O2﹣;F﹣;Na+;Mg;(2)A.电子层结构相同,核电荷数越大,离子半径越小;电子层数越大,半径越大,则微粒半径:r(Al3+)<r(Mg2+)<r(Na+)<r(F﹣)<r(O2﹣),故A正确;B.元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强,非金属性:Al<Si<P<S<Cl,则物质酸性:H3AlO3<H4SiO4<H3PO4<H2SO4<HClO4 , 故B正确;C.金属单质的原子半径越小,金属键越强,熔点越高,则熔点高低:Li>Na>K>Rb>Cs,故C正确;D.元素的非金属性越强,单质的氧化性越强,则与氢气化合越容易,单质的氧化性:F2>Cl2Br2>I2 , 则与氢气化合容易程度:F2>Cl2>Br2>I2 , 由于N2中含有N≡N,分子很稳定,所以氮气很难与氢气化合,所以与氢气化合容易程度:F2>Cl2>Br2>I2>N2 , 故D正确;所以答案是:ABCD;(3)有X、Y、Z、W四种元素,已知Y和X形成的化合物YX中,X的化合价为﹣1价,则Y为+1价,Y和Z可以形成化合物Y2Z,故Z为﹣2价,X、Y、Z离子的核外电子数目均为18,则X为Cl元素、Y为K元素,Z为S元素,W的+1价离子就是质子,则W为H元素,①KCl存在钾离子和氯离子,钾离子为简单阳离子,氯离子最外层为8电子,氯化钾的电子式为
该微粒含有12个质子和12个电子,为Mg;所以答案是:O2﹣;F﹣;Na+;Mg;(2)A.电子层结构相同,核电荷数越大,离子半径越小;电子层数越大,半径越大,则微粒半径:r(Al3+)<r(Mg2+)<r(Na+)<r(F﹣)<r(O2﹣),故A正确;B.元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强,非金属性:Al<Si<P<S<Cl,则物质酸性:H3AlO3<H4SiO4<H3PO4<H2SO4<HClO4 , 故B正确;C.金属单质的原子半径越小,金属键越强,熔点越高,则熔点高低:Li>Na>K>Rb>Cs,故C正确;D.元素的非金属性越强,单质的氧化性越强,则与氢气化合越容易,单质的氧化性:F2>Cl2Br2>I2 , 则与氢气化合容易程度:F2>Cl2>Br2>I2 , 由于N2中含有N≡N,分子很稳定,所以氮气很难与氢气化合,所以与氢气化合容易程度:F2>Cl2>Br2>I2>N2 , 故D正确;所以答案是:ABCD;(3)有X、Y、Z、W四种元素,已知Y和X形成的化合物YX中,X的化合价为﹣1价,则Y为+1价,Y和Z可以形成化合物Y2Z,故Z为﹣2价,X、Y、Z离子的核外电子数目均为18,则X为Cl元素、Y为K元素,Z为S元素,W的+1价离子就是质子,则W为H元素,①KCl存在钾离子和氯离子,钾离子为简单阳离子,氯离子最外层为8电子,氯化钾的电子式为 ![]() ;H2S为共价化合物,硫原子中最外层有8个电子达到稳定结构,分子中存在两个H﹣S键,电子式为:
;H2S为共价化合物,硫原子中最外层有8个电子达到稳定结构,分子中存在两个H﹣S键,电子式为: ![]() ;
;
所以答案是: ![]() ;
; ![]() ;.②Cl2与KOH反应生成KCl和KClO、水,其反应方程式为:Cl2+2KOH=KCl+KClO+H2O;
;.②Cl2与KOH反应生成KCl和KClO、水,其反应方程式为:Cl2+2KOH=KCl+KClO+H2O;
所以答案是:Cl2+2KOH=KCl+KClO+H2O.

【题目】铁及其化合物在生产和生活中有广泛的应用.
(1)铁元素在元素周期表中的位置为 .
(2)等物质的量的铁分别与足量的盐酸、水蒸气在一定条件下反应,产生相同条件下的气体体积比为 ,铁在高温条件下与水蒸气反应的化学方程式为 .
(3)碱式硫酸铁[Fe(OH)SO4]是一种用于污水处理的新型高效絮凝剂,在医药上也可用于治疗消化性溃疡出血.工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁的工艺流程如图: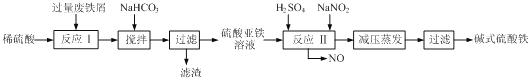
已知:常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
沉淀物 | Fe3+ | Fe2+ | Al3+ |
开始沉淀 | 2.3 | 7.5 | 3.4 |
完全沉淀 | 3.2 | 9.7 | 4.4 |
①加入少量NaHCO3的目的是调节pH,应控制pH的范围为 .
②碱式硫酸铁溶于水后产生的[Fe(OH)2+]离子,可部分水解生成聚合离子[Fe2(OH)42+].该水解反应的离子方程式为 .
(4)高铁酸钾(K2FeO4)也是常用的水处理剂.它的制备方法有多种.
①熔融法又称为过氧化钠氧化法.先在高温熔融的条件下制备高铁酸钠:Fe+3Na2O2=Na2FeO4+2Na2O,再将高铁酸钠加入到氢氧化钾溶液里,发生反应:2KOH+Na2FeO4=K2FeO4+2NaOH,请根据复分解反应原理分析该反应发生的原因: .
②电解法制备高铁酸钾.铁和石墨分别做两个电极的电极材料,氢氧化钠溶液做电解液实现电解制备.阴极的电极材料为 , 写出阳极的电极反应式为 .