题目内容
某研究性学习小组利用下列原料和流程制备CuSO4·5H2O。
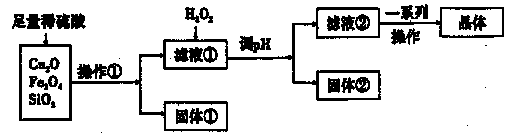
已知:Cu+在酸性条件下不稳定,易生成金属Cu和Cu2+。
(1)操作①的名称为____。 ,
(2)若固体①的成分为混合物,则其成分的化学式为____。
(3)将H2O2加入滤液①中,发生反应的离子方程式为 。
(4)调pH可选用的药品为____。
(5)获得的CuSO4·5H2O晶体表面附着杂质离子,常用酒精洗涤的原因是 。

已知:Cu+在酸性条件下不稳定,易生成金属Cu和Cu2+。
(1)操作①的名称为____。 ,
(2)若固体①的成分为混合物,则其成分的化学式为____。
(3)将H2O2加入滤液①中,发生反应的离子方程式为 。
(4)调pH可选用的药品为____。
| A.NaOH溶液 | B.CuO | C.氨水 | D.CuCO3 |
⑴过滤(1分)⑵SiO2、Cu(2分答错0分,答不全1分,下同)⑶2Fe2++H2O2+2H+=2Fe3++2H2O⑷B D (2分)⑸减少CuSO4·5H2O晶体的损失。(2分)
Cu2O+H2SO4=CuSO4+Cu+H2O,生成蓝色溶液和红色物质铜,Fe3O4与硫酸反应生成Fe2(SO4)3和FeSO4,Fe3+ 要与部分Cu反应,SiO2不与H2SO4反应,⑴操作①为过滤,将不溶于酸的SiO2和末反应的铜分离出去,故答案:⑴过滤(1分)⑵SiO2、Cu;⑶将H2O2加入滤液①中,将Fe2+ 氧化成Fe3+ 便于用水解的方法分离,2Fe2++H2O2+2H+=2Fe3++2H2O,答案:2Fe2++H2O2+2H+=2Fe3++2H2O;⑷Fe3+ 沉淀的pH为1.1-3.2,可以用CuO和CuCO3调pH,促进Fe3++3H2O Fe(OH)3+3H+ 水解平衡向正向移动,不用NaOH,NH3·H2O,生成Na2SO4,(NH4)2SO4难以除去,答案:B D;⑸酒精分子极性校小,CuSO4·5H2O晶体在其中的溶解度小,减少CuSO4·5H2O晶体的损失,提高产率。答案:减少CuSO4·5H2O晶体的损失,提高产率。
Fe(OH)3+3H+ 水解平衡向正向移动,不用NaOH,NH3·H2O,生成Na2SO4,(NH4)2SO4难以除去,答案:B D;⑸酒精分子极性校小,CuSO4·5H2O晶体在其中的溶解度小,减少CuSO4·5H2O晶体的损失,提高产率。答案:减少CuSO4·5H2O晶体的损失,提高产率。
考点:实验探究、铜及其化合物
 Fe(OH)3+3H+ 水解平衡向正向移动,不用NaOH,NH3·H2O,生成Na2SO4,(NH4)2SO4难以除去,答案:B D;⑸酒精分子极性校小,CuSO4·5H2O晶体在其中的溶解度小,减少CuSO4·5H2O晶体的损失,提高产率。答案:减少CuSO4·5H2O晶体的损失,提高产率。
Fe(OH)3+3H+ 水解平衡向正向移动,不用NaOH,NH3·H2O,生成Na2SO4,(NH4)2SO4难以除去,答案:B D;⑸酒精分子极性校小,CuSO4·5H2O晶体在其中的溶解度小,减少CuSO4·5H2O晶体的损失,提高产率。答案:减少CuSO4·5H2O晶体的损失,提高产率。考点:实验探究、铜及其化合物

练习册系列答案
 作业辅导系列答案
作业辅导系列答案 同步学典一课多练系列答案
同步学典一课多练系列答案 经典密卷系列答案
经典密卷系列答案
相关题目