题目内容
15.下列反应中,即属于氧化还原反应同时又是吸热反应的是( )| A. | Ba(OH)2•8H2O与NH4Cl反应 | B. | 铝与稀盐酸 | ||
| C. | 灼热的炭与CO2反应 | D. | 氢氧化钠溶液与醋酸溶液 |
分析 氧化还原反应的特征是有元素的化合价的升降,常见吸热反应有分解反应、氧化物与氢气、C、CO的反应等,结合对应物质的性质解答.
解答 解:A.Ba(OH)2•8H2O与NH4Cl反应,此反应中无化合价的变化,不是氧化还原反应,故A错误;
B.金属与酸的反应均属于放热反应,故B错误;
C.碳与二氧化碳反应中C元素的化合价发生变化,为氧化还原反应,反应吸热,故C正确;
D.酸碱中和反应为放热反应,故D错误,
故选C.
点评 本题考查氧化还原反应和常见吸热反应类型,为高考高频考点,侧重于学生基础知识的考查,注意把握元素化合价的判断和常见吸热反应、放热反应类型,题目难度不大.

练习册系列答案
相关题目
5.下列各组粒子能在指定溶液中大量共存的是( )
| A. | 银氨溶液中:Na+,H+,NO3- | B. | 碘化钾溶液中:H+,H2O,SO32- | ||
| C. | 偏铝酸钠溶液中:K+,Cl-,SO42- | D. | 氢氧化钙溶液中:Na+,ClO-,HCO3- |
6.元素周期表是学习化学的重要工具,它隐含着许多信息和规律.下面是八种短周期元素的相关信息(已知铍的原子半径为0.089nm)
F原子中无中子,G最高正价数与负价数相等,且最外层电子数是次外层的二倍,H元素单质焰色反应呈黄色.
(1)B元素在元素周期表中的位置第三周期第ⅢA族B形成的简单离子的结构示意图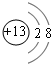 .
.
(2)上述元素的最高价氧化物对应的水化物中酸性最强的是H2SO4.
(3)用电子式表示C、H形成化合物的过程: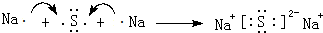 .
.
(4)H、E形成原子个数比为1:1的化合物中所含化学键类型为离子键和非极性键.
(5)G的最高价与E形成的化合物的电子式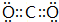 ,该分子的结构式为O=C=O.
,该分子的结构式为O=C=O.
(6)A、B、C、E原子半径由大到小的顺序为Mg>Al>S>O.
| 元素代号 | A | B | C | D | E |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.099 | 0.074 |
| 主要化合价 | +2 | +3 | +6,-2 | -1 | -2 |
(1)B元素在元素周期表中的位置第三周期第ⅢA族B形成的简单离子的结构示意图
 .
.(2)上述元素的最高价氧化物对应的水化物中酸性最强的是H2SO4.
(3)用电子式表示C、H形成化合物的过程:
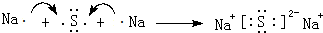 .
.(4)H、E形成原子个数比为1:1的化合物中所含化学键类型为离子键和非极性键.
(5)G的最高价与E形成的化合物的电子式
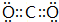 ,该分子的结构式为O=C=O.
,该分子的结构式为O=C=O.(6)A、B、C、E原子半径由大到小的顺序为Mg>Al>S>O.
3.下列属于天然高分子化合物的是( )
| A. | 聚乙烯 | B. | 硝化纤维 | C. | 淀粉 | D. | 油脂 |
10.某同学设计了由乙醇合成乙二醇的路线如下.下列说法正确的是( )
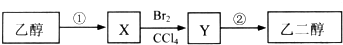

| A. | X可以发生加成反应 | |
| B. | 等物质的量的乙醇、X完全燃烧,消耗氧气的量不相同 | |
| C. | 步骤②需要在氢氧化钠醇溶液中反应 | |
| D. | 步骤①的反应类型是水解反应 |
7.下列物质注入水中,振荡后静置,能分层浮于水面的是( )
①溴苯 ②乙酸乙酯 ③乙醇 ④硝基苯 ⑤CCl4 ⑥苯.
①溴苯 ②乙酸乙酯 ③乙醇 ④硝基苯 ⑤CCl4 ⑥苯.
| A. | ①②③ | B. | ①②③⑥ | C. | ②③⑥ | D. | ②⑥ |
14.叠氮酸钠(NaN3)是抗禽流感药物“达菲”合成过程中的中间活性物质.NaN3受撞击会生成一种化合物Na3N,下列关于这两种化合物的说法不正确的是( )
| A. | 两者均属于离子化合物 | |
| B. | 两种化合物中所含有化学键类型相同 | |
| C. | Na3N与盐酸反应可得到2种盐 | |
| D. | Na3N中N3-半径比Na+半径大 |
 以H2为燃料的新型燃料电池,电池的工作示意图所示.若此电池以KOH为电解质溶液,试回答下列问题:
以H2为燃料的新型燃料电池,电池的工作示意图所示.若此电池以KOH为电解质溶液,试回答下列问题: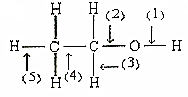 根据如图所示的乙醇分子结构判定在以下反应中分子中化学键的断裂情况.
根据如图所示的乙醇分子结构判定在以下反应中分子中化学键的断裂情况.