题目内容
【题目】CO是火力发电厂释放出的主要尾气,为减少对环境污染,发电厂试图采用CO与Cl2在催化剂的作用下合成光气(COCl2).某温度下,向2L的密闭容器中投入一定量的CO和Cl2 , 在催化剂的作用下发生反应:CO(g)+Cl2(g)COCl2(g)△H=a kJ/mol
反应过程中测定的部分数据如表:
t/min | n (CO)/mol | n (Cl2)/mol |
0 | 1.20 | 0.60 |
1 | 0.90 | |
2 | 0.80 | |
4 | 0.20 |
(1)比较各时段平均速率v(COCl2):v(0﹣1)v(0﹣2);v(0﹣2)v(1﹣2) (填“>”、“=”或“<”).
(2)在2min~4min间,v(Cl2)正v(Cl2)逆 (填“>”、“=”或“<”),该温度下K=
(3)已知X、L可分别代表温度或压强,如图表示L一定时,CO的砖化率随X的变化关系.
X代表的物理量是;a0 (填“>”,“=”,“<”),依据是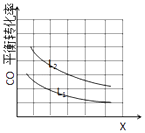
【答案】
(1)>;>
(2)=;5
(3)温度;<;因为X增大时,CO的平衡转化率降低,平衡逆向移动
【解析】解:(1)由表中数据,0﹣1min内,△n(CO)=1.2mol﹣0.9mol=0.3mol,由方程式可知△c(COCl2)=△c(CO)=0.3mol,则v(COCl2)= ![]() =0.15mol/(L.min),0~2min内△n(CO)=1.2mol﹣0.8mol=0.4mol,由方程式可知△c(COCl2)=△c(CO)=0.4mol,则v(COCl2)=
=0.15mol/(L.min),0~2min内△n(CO)=1.2mol﹣0.8mol=0.4mol,由方程式可知△c(COCl2)=△c(CO)=0.4mol,则v(COCl2)= ![]() 0.1mol/(L.min),1min﹣2min内,△n(CO)=0.9mol﹣0.8mol=0.1mol,由方程式可知△c(COCl2)=△c(CO)=0.1mol,则v(COCl2))=△c(CO)=
0.1mol/(L.min),1min﹣2min内,△n(CO)=0.9mol﹣0.8mol=0.1mol,由方程式可知△c(COCl2)=△c(CO)=0.1mol,则v(COCl2))=△c(CO)= ![]() =0.05mol/(L.min),v(0﹣1)>v(0﹣2);v(0﹣2)>v(1﹣2) , 故答案为:>;>;(2)4min内,反应的氯气为0.6mol﹣0.2mol=0.4mol,由方程式可知参加反应的CO为0.4mol,故4min时CO为1.2mol﹣0.4mol=0.8mol,与2min时CO的物质的量相等,则2min、4min处于平衡状态,在2min~4min间,v(Cl2)正 =v(Cl2)逆 ,
=0.05mol/(L.min),v(0﹣1)>v(0﹣2);v(0﹣2)>v(1﹣2) , 故答案为:>;>;(2)4min内,反应的氯气为0.6mol﹣0.2mol=0.4mol,由方程式可知参加反应的CO为0.4mol,故4min时CO为1.2mol﹣0.4mol=0.8mol,与2min时CO的物质的量相等,则2min、4min处于平衡状态,在2min~4min间,v(Cl2)正 =v(Cl2)逆 ,
由方程式可知,平衡时生成COCl2为0.4mol,该温度下平衡常数K= ![]() =
= ![]() =5,
=5,
故答案为:=;5;(3)正反应为气体体积减小的反应,增大压强平衡正向移动,CO转化率增大,而图中随X增大时,CO的平衡转化率降低,平衡逆向移动,则X为温度,正反应为放热反应,故a<0,
故答案为:温度;<;因为X增大时,CO的平衡转化率降低,平衡逆向移动.
(1)根据v= ![]() 计算v(COCl2)比较大小;(2)4min内,反应的氯气为0.6mol﹣0.2mol=0.4mol,由方程式可知参加反应的CO为0.4mol,故4min时CO为1.2mol﹣0.4mol=0.8mol,与2min时CO的物质的量相等,则2min、4min处于平衡状态;
计算v(COCl2)比较大小;(2)4min内,反应的氯气为0.6mol﹣0.2mol=0.4mol,由方程式可知参加反应的CO为0.4mol,故4min时CO为1.2mol﹣0.4mol=0.8mol,与2min时CO的物质的量相等,则2min、4min处于平衡状态;
由方程式可知,平衡时生成COCl2为0.4mol,平衡常数K= ![]() ;(3)正反应为气体体积减小的反应,增大压强平衡正向移动,CO转化率增大,而图中随X增大时,CO的平衡转化率降低,平衡逆向移动,则X为温度,正反应为放热反应.
;(3)正反应为气体体积减小的反应,增大压强平衡正向移动,CO转化率增大,而图中随X增大时,CO的平衡转化率降低,平衡逆向移动,则X为温度,正反应为放热反应.