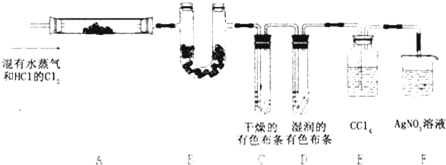
题目内容
某校化学实验兴趣小组欲采用如图1所示的实验装置制备Cl2,同时进行与氯气有关的某些实验,按要求回答问题.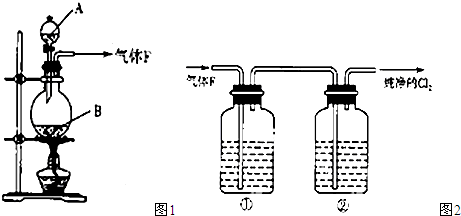
(1)A是浓盐酸,B为二氧化锰,将A滴入B中时发生反应的离子方程式为
(2)甲同学用含有0.2molHCl的浓盐酸与足量的MnO2反应制Cl2,结果制得的Cl2体积(标准状况下)小于1.12L,这是由于反应过程中盐酸浓度变小造成的.请列举导致盐酸浓度变小的原因:
(3)在实验室中,乙同学欲用图2中的装置净化氯气,则瓶①②中应盛放的试剂分别是①
(4)丙同学将纯净的Cl2通入一定量石灰乳中来制取漂白粉,若通入224mL(标准状况下) Cl2完全反应,则反应过程中转移电子的物质的量为
分析:(1)加热条件下浓盐酸和二氧化锰发生氧化还原反应生成氯化锰、氯气和水,结合配平写出;
(2)二氧化锰与浓盐酸反应,与稀盐酸不反应;
(3)用饱和食盐水除去氯气中的氯化氢气体;用浓硫酸干燥氯气;
(4)发生反应2Cl2+2Ca(OH)2═CaCl2+Ca(ClO)2+2H2O,氯气起氧化剂、还原剂作用,各占一半,据此计算转移电子物质的量.
(2)二氧化锰与浓盐酸反应,与稀盐酸不反应;
(3)用饱和食盐水除去氯气中的氯化氢气体;用浓硫酸干燥氯气;
(4)发生反应2Cl2+2Ca(OH)2═CaCl2+Ca(ClO)2+2H2O,氯气起氧化剂、还原剂作用,各占一半,据此计算转移电子物质的量.
解答:解:(1)加热条件下浓盐酸和二氧化锰发生氧化还原反应生成氯化锰、氯气和水,反应离子方程式为:MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O,
故答案为:MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O;
(2)浓盐酸与足量MnO2反应制取Cl2,反应需要加热,氯化氢易挥发,反应消耗氯化氢,同时生成水,随反应的不断进行浓盐酸的浓度逐渐变稀,稀盐酸不反应不与MnO2反应,
故答案为:①氯化氢挥发②反应生成水③反应消耗HCl;
(3)用饱和食盐水除去氯气中的氯化氢气体,用浓硫酸干燥氯气,先吸收HCl,再干燥,故①中盛放饱和食盐水,②中应盛放浓硫酸,
故答案为:饱和食盐水;浓硫酸;
(4)224mL(标准状况下) Cl2的物质的量=
=0.01mol,发生反应2Cl2+2Ca(OH)2═CaCl2+Ca(ClO)2+2H2O,氯气起氧化剂、还原剂作用,各占一半,其氧化剂的氯气,氯元素化合价由0价升高为+1价,故转移电子物质的量0.01mol×
×2=0.01mol,
故答案为:0.01mol.
| ||
故答案为:MnO2+4H++2Cl-
| ||
(2)浓盐酸与足量MnO2反应制取Cl2,反应需要加热,氯化氢易挥发,反应消耗氯化氢,同时生成水,随反应的不断进行浓盐酸的浓度逐渐变稀,稀盐酸不反应不与MnO2反应,
故答案为:①氯化氢挥发②反应生成水③反应消耗HCl;
(3)用饱和食盐水除去氯气中的氯化氢气体,用浓硫酸干燥氯气,先吸收HCl,再干燥,故①中盛放饱和食盐水,②中应盛放浓硫酸,
故答案为:饱和食盐水;浓硫酸;
(4)224mL(标准状况下) Cl2的物质的量=
| 0.224L |
| 22.4L/mol |
| 1 |
| 2 |
故答案为:0.01mol.
点评:本题考查氯气的制取原理、实验装置理解、常用化学用语、氯气的性质、化学计算等,难度不大,关键是清楚实验的目的与原理.注意用可溶性固体氯化物和浓硫酸代替浓盐酸,原理是利用高沸点的酸制备挥发性酸,生成的硫酸盐应为可溶性盐.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
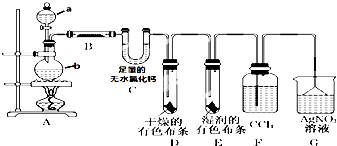 某校化学实验兴趣小组为了探究在实验室制备Cl2的过程中有水蒸气和HCl挥发出来,同时证明氯气的某些性质,甲同学设计了如图所示的实验装置(支撑用的铁架台省略),按要求回答问题.(1)①分别写出a、b的实验仪器名称
某校化学实验兴趣小组为了探究在实验室制备Cl2的过程中有水蒸气和HCl挥发出来,同时证明氯气的某些性质,甲同学设计了如图所示的实验装置(支撑用的铁架台省略),按要求回答问题.(1)①分别写出a、b的实验仪器名称