题目内容
某校化学实验兴趣小组在“探究卤素单质的氧化性”的系列实验中发现:在足量的稀氯化亚铁溶液中加入l-2滴溴水,振荡后溶液呈黄色.
(1)提出问题:Fe3+、Br2谁的氧化性更强?
(2)猜想:
①甲同学认为氧化性:Fe3+>Br2,故上述实验现象不是发生化学反应所致,则溶液里黄色是含
②乙同学认为氧化性:Fe3+<Br2,故上述实验现象是发生化学反应所致,则溶液呈黄色是含
(3)设计实验并验证
丙同学为验证乙同学的观点.选用下列某些试剂设计两种方案进行实验,并通过观察实验现象,证明了乙同学的观点确实是正确的.供选用的试剂:a、酚酞试液 b、四氯化碳 c、无水酒精 d、硫氰化钾溶液
请你在下列表格中写出丙同学选用的试剂及实验中观察到的现象.(试剂填序号)
(4)结论:氧化性:Fe3+<Br2,在足量的稀氯化亚铁溶液中,加入1~2滴溴水,溶液呈黄色所发生的离子反应方程式为
(5)实验后的思考:在2molFeBr2溶液中通入一定量的Cl2,当有33.6L Cl2(标准状况)与FeBr2溶液发生了反应,所发生反应的离子反应方程式为
(1)提出问题:Fe3+、Br2谁的氧化性更强?
(2)猜想:
①甲同学认为氧化性:Fe3+>Br2,故上述实验现象不是发生化学反应所致,则溶液里黄色是含
Br2
Br2
(填化学式,下同)所致.②乙同学认为氧化性:Fe3+<Br2,故上述实验现象是发生化学反应所致,则溶液呈黄色是含
Fe3+
Fe3+
所致.(3)设计实验并验证
丙同学为验证乙同学的观点.选用下列某些试剂设计两种方案进行实验,并通过观察实验现象,证明了乙同学的观点确实是正确的.供选用的试剂:a、酚酞试液 b、四氯化碳 c、无水酒精 d、硫氰化钾溶液
请你在下列表格中写出丙同学选用的试剂及实验中观察到的现象.(试剂填序号)
| 选用试剂(填序号) | 实验现象 | |
| 方案1 | b b |
下层(CCl4层)无色 下层(CCl4层)无色 |
| 方案2 | d d |
溶液变为血红色 溶液变为血红色 |
2Fe2++Br2=2Fe3++2Br-
2Fe2++Br2=2Fe3++2Br-
.(5)实验后的思考:在2molFeBr2溶液中通入一定量的Cl2,当有33.6L Cl2(标准状况)与FeBr2溶液发生了反应,所发生反应的离子反应方程式为
4Fe2++2Br-+3Cl2=4Fe3++Br2+6Cl-
4Fe2++2Br-+3Cl2=4Fe3++Br2+6Cl-
.分析:(2)Fe2+的颜色:浅绿色,Fe3+的颜色:棕黄色,溴水的颜色:橙黄色.根据题意在足量的氯化亚铁溶液中加入l-2滴溴水,如果不发生氧化还原反应,溶液呈黄色是由溴水引起的,如果发生反应:2 Fe2++Br2═2Fe3++2Br-,生成Fe3+,溶液呈黄色是由Fe3+引起的.即可得出甲同学、乙同学的结论;
(3)乙同学的观点认为氧化性:Fe3+<Br2,则会发生反应:2 Fe2++Br2═2 Fe3++2Br-,要设计方案进行实验证明乙同学的观点确实正确,考虑两种思路.第一,溶液中不存在Br2,然后选择合适试剂检验不存在Br2.第二,溶液中存在Fe3+,选择合适试剂检验存在Fe3+.即可确定乙同学观点正确;
(4)根据氧化还原反应原理确定反应物及其生成物,利用化合价升降法进行配平即可;
(5)FeBr2在溶液中电离出Fe2+、Br-,Cl2通入FeBr2溶液中,既能氧化Fe2+,又能氧化Br-;发生的反应为2 Fe2++Cl2═2Fe3++2Cl-、2Br-+Cl2═Br2+2Cl-.根据还原性:Fe2+>Br-,因此Cl2先氧化Fe2+,后氧化Br-.再利用各物质量的不同,确定出发生的离子反应.
(3)乙同学的观点认为氧化性:Fe3+<Br2,则会发生反应:2 Fe2++Br2═2 Fe3++2Br-,要设计方案进行实验证明乙同学的观点确实正确,考虑两种思路.第一,溶液中不存在Br2,然后选择合适试剂检验不存在Br2.第二,溶液中存在Fe3+,选择合适试剂检验存在Fe3+.即可确定乙同学观点正确;
(4)根据氧化还原反应原理确定反应物及其生成物,利用化合价升降法进行配平即可;
(5)FeBr2在溶液中电离出Fe2+、Br-,Cl2通入FeBr2溶液中,既能氧化Fe2+,又能氧化Br-;发生的反应为2 Fe2++Cl2═2Fe3++2Cl-、2Br-+Cl2═Br2+2Cl-.根据还原性:Fe2+>Br-,因此Cl2先氧化Fe2+,后氧化Br-.再利用各物质量的不同,确定出发生的离子反应.
解答:解:(2)Fe2+的颜色:浅绿色,Fe3+的颜色:棕黄色,溴水的颜色:橙黄色.
根据题意在足量的氯化亚铁溶液中加入l-2滴溴水,若Fe3+氧化性强于Br2,则不发生氧化还原反应,溶液呈黄色是由加入溴水引起的;如果Br2氧化性强于Fe3+,则发生反应:2Fe2++Br2═2 Fe3++2Br-,生成了Fe3+,则溶液呈黄色是由Fe3+引起的.因此①中甲同学认为氧化性:Fe3+>Br2,不发生反应,溶液呈黄色是由溴水引起的;②中乙同学认为氧化性:Fe3+<Br2,发生反应生成Fe3+,溶液呈黄色是由Fe3+引起的,
故答案为:Br2;Fe3+;
(3)乙同学的观点认为氧化性:Fe3+<Br2,则会发生反应:2 Fe2++Br2═2Fe3++2Br-,由于溴水少量,要全部参与反应,生成物中生成了Fe3+.
要证明乙同学的观点确实正确,设计两种方案进行实验.方案一:证明溶液中不存在Br2,根据题意,选择试剂四氯化碳来进行萃取实验,由于四氯化碳呈无色、密度大于水、与水不互溶、易溶解Br2,观察到现象为:出现分层现象,下层为四氯化碳,且呈无色.则证明方案一正确.
方案二:证明溶液中存在Fe3+.根据题意,选择试剂硫氰化钾溶液,观察到现象为溶液呈血红色.则证明方案二正确.方案一、方案二都正确即可证明乙同学的观点确实正确.
故答案为:
(4)根据结论:氧化性:Fe3+<Br2,在足量的稀氯化亚铁溶液中,加入1~2滴溴水时,Br2可以把Fe2+氧化成Fe3+,
Br2本身被还原成Br-.确定出反应物和生成物后Fe2++Br2-Fe3++Br-,再根据化合价升降法配平,+2价Fe上升到+3价
Fe,化合价上升1价,Br2中0价降低到-1价,一共降低2价,所以Fe2+前计量数为2,Br2前计量数为1,根据原子守恒,Fe3+前计量数为2,Br-前计量数为2.
故离子方程式为2 Fe2++Br2═2Fe3++2Br-,故答案为:2 Fe2++Br2═2Fe3++2Br-;
(5)FeBr2在溶液中电离出Fe2+、Br-,Cl2通入FeBr2溶液中,既能氧化Fe2+,又能氧化Br-.发生的反应为2Fe2++Cl2═2Fe3++2Cl-、2Br-+Cl2═Br2+2Cl-,
根据反应2Fe2++Br2═2Fe3++2Br-,还原剂是Fe2+,还原产物是Br-,还原剂的还原性强于还原产物的还原性,即得还原性:Fe2+>Br-,因此Cl2先氧化Fe2+,后氧化Br-.
根据已知条件,2molFeBr2溶液中,n(Fe2+)=2mol,n(Br-)=4mol,
V(Cl2)═33.6L,n(Cl2)═
═1.5mol,
设Cl2先氧化Fe2+的反应中消耗Cl2物质的量为x,
根据反应:2Fe2++Cl2═2Fe3++2Cl-、
2mol 1mol
2mol x
解得 x=1mol,
则氧化Br-的Cl2物质的量为0.5mol,根据反应2Br-+Cl2═Br2+2Cl-可知,0.5molCl2氧化1molBr-,
反应物中参加反应各物质的物质的量为n(Fe2+)═2mol,n(Br-)═1mol,n(Cl2)=1.5mol,
n(Fe2+):n(Br-):n(Cl2)═4:2:3,即可确定反应物前计量数,再根据原子守恒确定生成物前计量数,得离子方程式为4Fe2++2Br-+3Cl2═4Fe3++Br2+6Cl-,
故答案为:4Fe2++2Br-+3Cl2═4Fe3++Br2+6Cl-.
根据题意在足量的氯化亚铁溶液中加入l-2滴溴水,若Fe3+氧化性强于Br2,则不发生氧化还原反应,溶液呈黄色是由加入溴水引起的;如果Br2氧化性强于Fe3+,则发生反应:2Fe2++Br2═2 Fe3++2Br-,生成了Fe3+,则溶液呈黄色是由Fe3+引起的.因此①中甲同学认为氧化性:Fe3+>Br2,不发生反应,溶液呈黄色是由溴水引起的;②中乙同学认为氧化性:Fe3+<Br2,发生反应生成Fe3+,溶液呈黄色是由Fe3+引起的,
故答案为:Br2;Fe3+;
(3)乙同学的观点认为氧化性:Fe3+<Br2,则会发生反应:2 Fe2++Br2═2Fe3++2Br-,由于溴水少量,要全部参与反应,生成物中生成了Fe3+.
要证明乙同学的观点确实正确,设计两种方案进行实验.方案一:证明溶液中不存在Br2,根据题意,选择试剂四氯化碳来进行萃取实验,由于四氯化碳呈无色、密度大于水、与水不互溶、易溶解Br2,观察到现象为:出现分层现象,下层为四氯化碳,且呈无色.则证明方案一正确.
方案二:证明溶液中存在Fe3+.根据题意,选择试剂硫氰化钾溶液,观察到现象为溶液呈血红色.则证明方案二正确.方案一、方案二都正确即可证明乙同学的观点确实正确.
故答案为:
| 选用试剂(填序号) | 实验现象 | |
| 方案1 | b | 下层(CCl4层)无色 |
| 方案2 | d | 溶液变为血红色 |
Br2本身被还原成Br-.确定出反应物和生成物后Fe2++Br2-Fe3++Br-,再根据化合价升降法配平,+2价Fe上升到+3价
Fe,化合价上升1价,Br2中0价降低到-1价,一共降低2价,所以Fe2+前计量数为2,Br2前计量数为1,根据原子守恒,Fe3+前计量数为2,Br-前计量数为2.
故离子方程式为2 Fe2++Br2═2Fe3++2Br-,故答案为:2 Fe2++Br2═2Fe3++2Br-;
(5)FeBr2在溶液中电离出Fe2+、Br-,Cl2通入FeBr2溶液中,既能氧化Fe2+,又能氧化Br-.发生的反应为2Fe2++Cl2═2Fe3++2Cl-、2Br-+Cl2═Br2+2Cl-,
根据反应2Fe2++Br2═2Fe3++2Br-,还原剂是Fe2+,还原产物是Br-,还原剂的还原性强于还原产物的还原性,即得还原性:Fe2+>Br-,因此Cl2先氧化Fe2+,后氧化Br-.
根据已知条件,2molFeBr2溶液中,n(Fe2+)=2mol,n(Br-)=4mol,
V(Cl2)═33.6L,n(Cl2)═
| 33.6L |
| 22.4L/mol |
设Cl2先氧化Fe2+的反应中消耗Cl2物质的量为x,
根据反应:2Fe2++Cl2═2Fe3++2Cl-、
2mol 1mol
2mol x
解得 x=1mol,
则氧化Br-的Cl2物质的量为0.5mol,根据反应2Br-+Cl2═Br2+2Cl-可知,0.5molCl2氧化1molBr-,
反应物中参加反应各物质的物质的量为n(Fe2+)═2mol,n(Br-)═1mol,n(Cl2)=1.5mol,
n(Fe2+):n(Br-):n(Cl2)═4:2:3,即可确定反应物前计量数,再根据原子守恒确定生成物前计量数,得离子方程式为4Fe2++2Br-+3Cl2═4Fe3++Br2+6Cl-,
故答案为:4Fe2++2Br-+3Cl2═4Fe3++Br2+6Cl-.
点评:本题考查氧化还原反应基础知识,联系元素及其化合物,设计探究实验,判断氧化性、还原性的强弱.需具备一定的实验能力和综合思维能力,尤其是氧化性、还原性强弱的判断及根据量的不同书写离子方程式,非常容易出错,需要注意多练习.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
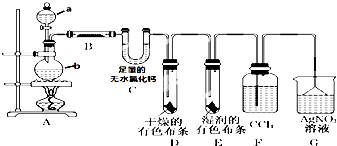 某校化学实验兴趣小组为了探究在实验室制备Cl2的过程中有水蒸气和HCl挥发出来,同时证明氯气的某些性质,甲同学设计了如图所示的实验装置(支撑用的铁架台省略),按要求回答问题.(1)①分别写出a、b的实验仪器名称
某校化学实验兴趣小组为了探究在实验室制备Cl2的过程中有水蒸气和HCl挥发出来,同时证明氯气的某些性质,甲同学设计了如图所示的实验装置(支撑用的铁架台省略),按要求回答问题.(1)①分别写出a、b的实验仪器名称