题目内容
【题目】“低碳经济”已成为全世界科学家研究的重要课题。为减小和消除CO2对环境的影响,一方面世界各国都在限制其排放量,另一方面科学家加强了对CO2创新利用的研究。
(1)已知:①CO(g)+H2O(g)![]() H2(g)+CO2(g) ΔH=-41 kJ·mol-1
H2(g)+CO2(g) ΔH=-41 kJ·mol-1
②C(s)+2H2(g)![]() CH4(g) ΔH=-73 kJ·mol-1
CH4(g) ΔH=-73 kJ·mol-1
③2CO(g)![]() C(s)+CO2(g) ΔH=-171 kJ·mol-1
C(s)+CO2(g) ΔH=-171 kJ·mol-1
写出CO2与H2反应生成CH4和H2O(g)的热化学方程式:_____________________________________。
(2)目前工业上有一种方法是用CO2来生产燃料甲醇。为探究该反应原理,在容积为2 L的密闭容器中,充入1 mol CO2和3.25 mol H2在一定条件下发生反应,测得CO2、CH3OH(g)和H2O(g)的物质的量(n)随时间的变化如图所示:
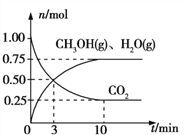
①反应的化学方程式为:____________________________________________________。
②从反应开始到平衡,氢气的平均反应速率v(H2)=_____________mol/(Lmin)。
(3)煤化工通常研究不同条件下CO转化率以解决实际问题。已知在催化剂存在条件下反应:CO(g)+H2O(g)![]() H2(g)+CO2(g)中CO的平衡转化率随p(H2O)/p(CO)及温度变化关系如图所示: [p(H2O)、p(CO)表示H2O、CO的平衡分压,分压=总压×物质的量分数]:
H2(g)+CO2(g)中CO的平衡转化率随p(H2O)/p(CO)及温度变化关系如图所示: [p(H2O)、p(CO)表示H2O、CO的平衡分压,分压=总压×物质的量分数]:
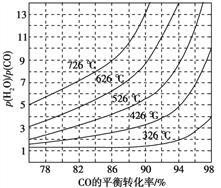
①上述反应的逆反应方向是_____________反应(填“吸热”或“放热”);
②对于气相反应,用某组分(B)的平衡分压(pB)代替平衡浓度(cB)也可以表示平衡常数(记作Kp),,则该反应的Kp=______________,提高![]()
![]() ,则Kp_____________(填“变大”“变小”或“不变”)。使用铁镁催化剂的实际工业流程中,一般采用400 ℃左右、
,则Kp_____________(填“变大”“变小”或“不变”)。使用铁镁催化剂的实际工业流程中,一般采用400 ℃左右、![]()
![]() =3~5,采用此条件的原因可能是______________________________________________________________________。
=3~5,采用此条件的原因可能是______________________________________________________________________。
【答案】 CO2(g)+4H2(g)![]() CH4(g)+2H2O(g);ΔH=-162kJmol-1 CO2+3H2
CH4(g)+2H2O(g);ΔH=-162kJmol-1 CO2+3H2![]() CH3OH+H2O 0.1125 吸热
CH3OH+H2O 0.1125 吸热 ![]() 不变 投料比太低,CO的转化率不太高,而投料比3~5时转化率已经很高达到96%~98%,再增加投料比,需要大大的增加蒸汽添加量,这样在在经济上不合算,催化剂的活性温度在400℃左右
不变 投料比太低,CO的转化率不太高,而投料比3~5时转化率已经很高达到96%~98%,再增加投料比,需要大大的增加蒸汽添加量,这样在在经济上不合算,催化剂的活性温度在400℃左右
【解析】(1)已知:①CO(g)+H2O(g)![]() H2(g)+CO2(g) ΔH1=-41 kJ·mol-1
H2(g)+CO2(g) ΔH1=-41 kJ·mol-1
②C(s)+2H2(g)![]() CH4(g) ΔH2=-73 kJ·mol-1
CH4(g) ΔH2=-73 kJ·mol-1
③2CO(g)![]() C(s)+CO2(g) ΔH3=-171 kJ·mol-1
C(s)+CO2(g) ΔH3=-171 kJ·mol-1
根据盖斯定律,由③-2×①+②得反应CO2(g)+4H2(g)![]() CH4(g)+2H2O(g);ΔH=ΔH3-2×ΔH1+ΔH2=-171 kJ·mol-1-2×(-41 kJ·mol-1)+(-73 kJ·mol-1)=-162kJmol-1;(2) ①根据图中曲线信息可知,v(CO2)=
CH4(g)+2H2O(g);ΔH=ΔH3-2×ΔH1+ΔH2=-171 kJ·mol-1-2×(-41 kJ·mol-1)+(-73 kJ·mol-1)=-162kJmol-1;(2) ①根据图中曲线信息可知,v(CO2)=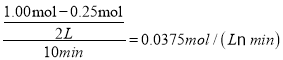 、v(H2O)=v(CH3OH)=
、v(H2O)=v(CH3OH)=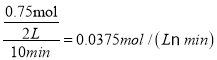 ,根据化学反应速率之比等于反应方程式的计量数之比可知反应中CO2、CH3OH(g)和H2O(g)的系数均为1,结合化学方程式配平可得反应的化学方程式为:CO2+3H2
,根据化学反应速率之比等于反应方程式的计量数之比可知反应中CO2、CH3OH(g)和H2O(g)的系数均为1,结合化学方程式配平可得反应的化学方程式为:CO2+3H2![]() CH3OH+H2O;②根据反应速率之比等于计量数之比,从反应开始到平衡,氢气的平均反应速率v(H2)=3v(CO2)=
CH3OH+H2O;②根据反应速率之比等于计量数之比,从反应开始到平衡,氢气的平均反应速率v(H2)=3v(CO2)=![]() ;(3)①由图可知p(H2O)/p(CO)相同时温度越高CO的平衡转化率越小,说明升高温度平衡向逆反应方向移动,则逆反应为吸热反应;②对于气相反应,用某组分(B)的平衡压强(pB)代替物质的量浓度也可以表示平衡常数(记作Kp),反应的平衡常数=
;(3)①由图可知p(H2O)/p(CO)相同时温度越高CO的平衡转化率越小,说明升高温度平衡向逆反应方向移动,则逆反应为吸热反应;②对于气相反应,用某组分(B)的平衡压强(pB)代替物质的量浓度也可以表示平衡常数(记作Kp),反应的平衡常数=![]() ;平衡常数只与温度有关,与浓度无关,所以提高
;平衡常数只与温度有关,与浓度无关,所以提高![]() 比,则KP不变;由图象可知,投料比太低,CO的转化率不太高,而投料比3~5时转化率已经很高达到96%~98%,再增加投料比,需要大大的增加蒸汽添加量,这样在在经济上不合算,催化剂的活性温度在400℃左右,所以一般采用400℃左右,
比,则KP不变;由图象可知,投料比太低,CO的转化率不太高,而投料比3~5时转化率已经很高达到96%~98%,再增加投料比,需要大大的增加蒸汽添加量,这样在在经济上不合算,催化剂的活性温度在400℃左右,所以一般采用400℃左右, ![]() =3~5。
=3~5。

 同步轻松练习系列答案
同步轻松练习系列答案