题目内容
6.下列变化不需要破坏化学键的是( )| A. | HCl气体溶于水 | B. | 加热HI气体使之分解 | ||
| C. | NaCl溶于水 | D. | 碘晶体受热转变成碘蒸气 |
分析 共价化合物与离子化合物溶于水电离时都破坏化学键,共价化合物熔化时可能破坏化学键,但分子晶体的三态变化中不破坏化学键.
解答 解:A.HCl溶于水破坏共价键,故A不选;
B.加热HI气体使之分解,破坏共价键,故B不选;
C.NaCl溶于水破坏离子键,故C不选;
D.碘晶体受热转变成碘蒸气,破坏分子间作用力,故D选.
故选D.
点评 本题考查化学键,明确化学键的形成原因及判断化学键的一般规律即可解答,难度不大,并注意常见的物质中的化学键来解答.

练习册系列答案
相关题目
16.下列说法正确的是( )
| A. | 热化学方程式中,化学式前面的化学计量数既可表示微粒数,又可表示物质的量 | |
| B. | 书写热化学方程式时,不仅要写明反应热的符号、数值和单位,还要注明各物质的聚集状态 | |
| C. | 热化学方程式中,如果没有注明温度和压强,则表示在标准状况下测得的数据 | |
| D. | 凡是化合反应都是放热反应,分解反应都是吸热反应 |
14.下列说法正确的是( )
| A. | 加热使氧化镁熔化不需要破坏化学键 | |
| B. | 分子间作用力比化学键强的多 | |
| C. | 加热使冰融化主要破坏分子间作用力 | |
| D. | 化学键是指物质中相邻的原子或离子间的强烈的吸引作用 |
1.有六种微粒,它们分别是:${\;}_{19}^{40}M$、${\;}_{20}^{40}N$、${\;}_{18}^{40}X$、${\;}_{19}^{40}Q$+、${\;}_{20}^{40}Y$2+、${\;}_{17}^{40}Z$-,它们所属元素的种类为( )
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
18.在一定温度下,向aL密闭容器中加入1molX气体和2molY气体,发生如下反应:X(g)+2Y(g)?2Z(g),此反应达到平衡的标志是( )
| A. | 容器内气体质量不随时间变化 | |
| B. | 容器内各物质的压强不随时间变化 | |
| C. | 容器内混合气体的密度不随时间变化 | |
| D. | 单位时间内消耗0.1mol X的同时生成0.2molZ |
15.依据下列实验现象与得出的结论关系正确的是( )
| 操作 | 实验现象 | 结论 | |
| A | 将铝片放入盐酸中 | 产生气泡的速率开始时较慢,随后加快,后来又逐渐减慢 | H+的浓度是影响反应速率的唯一因素 |
| B | 将形状大小相近的Mg和Al片分别放入相同浓度的盐酸中 | Mg与盐酸反应比Al剧烈 | Mg比Al的金属性强 |
| C | 氢气在氯气中点燃 | 有苍白色火焰,瓶口有白雾 | 其中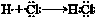 过程 过程吸收能量 |
| D | 将一小块钠投入冷水中 | 钠熔化成小球 |  |
| A. | A | B. | B | C. | C | D. | D |
16.少量的金属钠长期暴露在空气中,其最终产物不可能是( )
| A. | Na2CO3 | B. | Na2CO3•7H20 | C. | Na2O2 | D. | Na2CO3•10H20 |
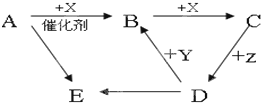 现有A、B、C、D、E五种物质,它们均含同一种元素,有以下转化关系:已知A、B、C、X在常温下为气体,Z为液体,Y为紫红色金属,A与D的浓溶液相遇会产生白烟E.
现有A、B、C、D、E五种物质,它们均含同一种元素,有以下转化关系:已知A、B、C、X在常温下为气体,Z为液体,Y为紫红色金属,A与D的浓溶液相遇会产生白烟E. ;煤的另一种化工方法是将煤在高温条件下与水蒸气反应制造水煤气,写出该反应的化学方程式C+H2O$\frac{\underline{\;高温\;}}{\;}$CO+H2.
;煤的另一种化工方法是将煤在高温条件下与水蒸气反应制造水煤气,写出该反应的化学方程式C+H2O$\frac{\underline{\;高温\;}}{\;}$CO+H2.