题目内容
【题目】物质的类别和核心元素的化合价是研究物质性质的两个基本视角。
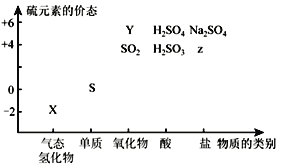

(1)图中Y物质的化学式为______。
(2)治理含CO、SO2的烟道气,可以将其在催化剂作用下转化为单质S和无毒的气体.则治理烟道气反应的化学方程式为____________________________。
(3)实验室中X气体由不溶性的硫化亚铁(FeS)固体和稀硫酸混合反应制得,该反应的离子方程式为:_____________________________________________。
(4)Na2S2O3(硫代硫酸钠)是一种用途广泛的钠盐。
①下列物质用于Na2S2O3的制备,从氧化还原反应的角度,理论上有可能的是___。
a.Na2S+S b.Z+S c.Na2SO3+Y d.NaHS+NaHSO3
②Na2S2O3具有较强还原性,能作为织锦物漂白后的脱氯剂,脱氯后S2O32-转变为SO42-。 现需处理含标准状况下Cl2 2.24L的织锦物,理论上需要0.00100mol/L Na2S2O3溶液的体积为_______L。
【答案】SO3 2CO+SO2 ![]() 2CO2+S FeS+2H+=Fe2++H2S↑ bd 25
2CO2+S FeS+2H+=Fe2++H2S↑ bd 25
【解析】
依据元素化合价和物质分类分析,X为气态氢化物为H2S,Y为硫元素的+6价氧化物为SO3,Z为+4价的盐可以为Na2SO3。
(1)Y是S元素化合价为+6价;
(2)根据反应物、生成物,结合反应中电子转移数目相等,可得反应方程式;
(3)FeS与稀硫酸发生复分解反应产生H2S和FeSO4,根据离子方程式中物质拆分原则书写反应的离子方程式;
(4)①Na2S2O3中S为+2价,从氧化还原的角度分析,反应物中S元素化合价必须分别大于2和小于2;
②根据元素化合价升降总数相等,计算反应消耗的Na2S2O3的物质的量,再根据n=cV计算其物质的量。
根据上述推断可知X是H2S,Y是SO3,Z是Na2SO3。
(1)Y为S元素的氧化物,化合价为+6价,则Y为SO3;
(2) CO、SO2反应产生S单质和CO2,根据电子守恒、原子守恒,可得反应方程式为:2CO+SO2 ![]() 2CO2+S;
2CO2+S;
(3)FeS与稀硫酸发生复分解反应产生H2S和FeSO4,反应的离子方程式为:FeS+2H+=Fe2++H2S↑;
(4)①Na2S2O3中S为+2价,从氧化还原的角度分析,反应物中S元素化合价必须分别大于2和小于2,A中S化合价都小于2,C中物质中S化合价都大于+2价,B、D中S元素化合价必须分别大于2和小于2,故合理选项是bd;
②根据题干信息可知发生反应方程式为:Na2S2O3+4Cl2+5H2O=2NaCl+2H2SO4+6HCl,标准状况下2.24L Cl2的物质的量是n(Cl2)=2.24L÷22.4L/mol=0.1mol,在反应中获得电子变为-1价的Cl-,0.1molCl2获得电子的物质的量是0.2mol;S2O32-转变为SO42-,每1mol S2O32-失去8mol电子,则转移0.2mol电子,需消耗S2O32-的物质的量n(S2O32-)=0.2mol÷8=0.025mol,根据n=c·V可知理论上需要0.00100mol/L Na2S2O3溶液的体积V=0.025mol÷0.00100mol/L=25L。

 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案 品学双优卷系列答案
品学双优卷系列答案【题目】Bodensteins研究反应H2(g)+I2(g)![]() 2HI(g) △H<0 ,温度为T时,在两个体积均为1L的密闭容器中进行实验,测得气体混合物中碘化氢的物质的量分数w(HI)与反应时间t的关系如下表:
2HI(g) △H<0 ,温度为T时,在两个体积均为1L的密闭容器中进行实验,测得气体混合物中碘化氢的物质的量分数w(HI)与反应时间t的关系如下表:
容器编号 | 起始物质 | t/min | 0 | 20 | 40 | 60 | 80 | 100 |
Ⅰ | 0.5molI2、0.5molH2 | w(HI)/% | 0 | 50 | 68 | 76 | 80 | 80 |
Ⅱ | xmolHI | w(HI)/% | 100 | 91 | 84 | 81 | 80 | 80 |
研究发现上述反应中:v正=kaw(H2)w(I2),v逆=kbw2(HI),其中ka、kb为常数。下列说法不正确的是( )
A. 温度为T时,该反应![]() =64
=64
B. 容器I中在前20min的平均速率v(HI)=0.025molL-1min-1
C. 若起始时,向容器I中加入物质的量均为0.1mol的H2、I2、HI,反应逆向进行
D. 无论x为何值,两容器中达平衡时w(HI)%均相同