题目内容
【题目】盐在化学工业中有重要的应用,请回答下列问题
(1)用离子方程式表示FeCl3可作净水剂的原因:___________________ 。
(2)常温下,在pH=3的硫酸与pH=11的Na2S溶液中,水电离出来的c(OH-)之比为_____ , 向Na2S溶液中加入AlCl3溶液时,产生白色沉淀和有臭鸡蛋味的气体,其离子方程式为:_________________。
(3)c(NH4+)相等的下列溶液① NH4Cl ②NH4HSO4 ③(NH4)2SO4 ④CH3COONH4
⑤NH3 H2O,溶液的物质的量浓度由小到大的顺序是__________ (用序号表示)
(4)已知t ℃时AgCl的Ksp=2×10-10 ;(2)在t ℃时,Ag2CrO4在水中的沉淀溶解平衡曲线如图所示。下列正确的是 _______
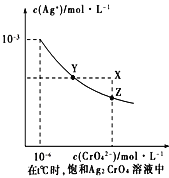
A.在t ℃时,Ag2CrO4的Ksp为1×10-9
B.t ℃时,在饱和Ag2CrO4溶液中加入K2CrO4 可使溶液由Y点到X点
C.在t ℃时,以0.01mol/L AgNO3溶液滴定20mL0.01 mol/L KCl和0.01 mol/L的K2CrO4的混合溶液,Cl-先沉淀
D.在t ℃时,AgCl的溶解度大于Ag2CrO4
(5)已知某温度时:Ksp[Fe(OH)3]=1×10-38,Ksp[Cu(OH)2]=1×10-20。在该温度下向Fe3+、Cu2+均为0.01molL-1的溶液中逐滴加入NaOH溶液,要Fe3+完全沉淀,而Cu2+不产生沉淀,溶液中PH应控制的范围是_______。(当离子浓度小于1×10-5mol/L时,认为完全沉淀)。
【答案】 Fe3++3H2O![]() Fe(OH)3+3H+ 10-8:1或1:108 2A3++3S2-+6H2O=2Al(OH)3+3H2S↑ ③<②<①<④<⑤ C 3<PH≤5
Fe(OH)3+3H+ 10-8:1或1:108 2A3++3S2-+6H2O=2Al(OH)3+3H2S↑ ③<②<①<④<⑤ C 3<PH≤5
【解析】(1)氯化铁水解生成氢氧化铁胶体,可用作净水剂,反应的离子方程式为Fe3++3H2O![]() Fe(OH)3+3H+。(2)硫酸抑制水的电离,硫化钠水解促进水的电离,则常温下,在pH=3的硫酸与pH=11的Na2S溶液中,水电离出来的c(OH-)之比为10-11:10-3=1:108;向Na2S溶液中加入AlCl3溶液时,产生白色沉淀和有臭鸡蛋味的气体,白色沉淀是氢氧化铝,气体是H2S,反应的离子方程式为2A3++3S2-+6H2O=2Al(OH)3+3H2S↑。(3)铵根水解显酸性,水解显碱性的阴离子促进铵根水解,水解显酸性或能电离出氢离子的抑制铵根水解,则c(NH4+)相等溶液中,溶液的物质的量浓度由小到大的顺序是③<②<①<④<⑤;(4)A、依据图象曲线上的数据结合溶度积常数概念计算得到;曲线上的点是沉淀溶解平衡,Ag2CrO4的沉淀溶剂平衡为:Ag2CrO4(s)2Ag++CrO42-,Ksp=c2(Ag+)c(CrO42-)=(10-3)2×10-6=10-12,A错误;B、在饱和Ag2CrO4溶液中加入K2CrO4仍为饱和溶液,点仍在曲线上,所以在饱和Ag2CrO4溶液中加入K2CrO4不能使溶液由Y点变为X点,B错误;C、用AgNO3溶液滴定过程中,由于AgCl的溶解度小,AgCl先沉淀出来,C正确;D、已知t℃时AgCl的Ksp=2×10-10,由A 知Ag2CrO4的Ksp为1×10-12,则c(AgCl)=
Fe(OH)3+3H+。(2)硫酸抑制水的电离,硫化钠水解促进水的电离,则常温下,在pH=3的硫酸与pH=11的Na2S溶液中,水电离出来的c(OH-)之比为10-11:10-3=1:108;向Na2S溶液中加入AlCl3溶液时,产生白色沉淀和有臭鸡蛋味的气体,白色沉淀是氢氧化铝,气体是H2S,反应的离子方程式为2A3++3S2-+6H2O=2Al(OH)3+3H2S↑。(3)铵根水解显酸性,水解显碱性的阴离子促进铵根水解,水解显酸性或能电离出氢离子的抑制铵根水解,则c(NH4+)相等溶液中,溶液的物质的量浓度由小到大的顺序是③<②<①<④<⑤;(4)A、依据图象曲线上的数据结合溶度积常数概念计算得到;曲线上的点是沉淀溶解平衡,Ag2CrO4的沉淀溶剂平衡为:Ag2CrO4(s)2Ag++CrO42-,Ksp=c2(Ag+)c(CrO42-)=(10-3)2×10-6=10-12,A错误;B、在饱和Ag2CrO4溶液中加入K2CrO4仍为饱和溶液,点仍在曲线上,所以在饱和Ag2CrO4溶液中加入K2CrO4不能使溶液由Y点变为X点,B错误;C、用AgNO3溶液滴定过程中,由于AgCl的溶解度小,AgCl先沉淀出来,C正确;D、已知t℃时AgCl的Ksp=2×10-10,由A 知Ag2CrO4的Ksp为1×10-12,则c(AgCl)=![]() ,而c(Ag2CrO4)=
,而c(Ag2CrO4)=![]() ,所以在t℃时,AgCl的溶解度小于Ag2CrO4,D错误;答案选C。(5)铁离子完全沉淀时氢氧根浓度是
,所以在t℃时,AgCl的溶解度小于Ag2CrO4,D错误;答案选C。(5)铁离子完全沉淀时氢氧根浓度是![]() ,pH=3;铜离子开始沉淀时氢氧根浓度是
,pH=3;铜离子开始沉淀时氢氧根浓度是![]() ,pH=5,即溶液中pH应控制的范围是3<pH≤5。
,pH=5,即溶液中pH应控制的范围是3<pH≤5。

【题目】实验室以苯甲醛为原料制备间溴苯甲醛(实验装置见下图:相关物质的物理性质见下列附表)。

物质 | 相对分 子质量 | 密度 /(g.cm-3) | 沸点/℃ |
溴 | 160 | 3.119 | 58.8 |
苯甲醛 | 106 | 1.04 | 179 |
1,2—二氯乙烷 | 99 | 1.2351 | 83.5 |
间溴苯甲醛 | 185 | 1.587 | 229 |
有关实验步骤如下:
步骤1:向三颈烧瓶中加入一定配比的无水AlCl3、1,2—二氯乙烷和苯甲醛(5.3g),充分混合后,升温至60℃,缓慢滴加经浓硫酸干燥过的液溴,保温反应一段时间,冷却。.
步骤2:将反应混合物缓慢加入一定量的稀盐酸中,搅拌、静置、分液。有机相用10%NaHCO3溶液洗涤。
步骤3:经洗涤的有机相加入适量无水硫酸钙固体,放置一段时间后过滤。
步骤4:为了防止间溴苯甲醛因温度过高被氧化,把步骤3处理得到的间溴苯甲醛加入少量锌粉,同时采用某种技术处理后收集相应馏分,共收集到间溴苯甲醛3.7g。
(1)实验装置中采用的加热方式为________;冷凝管的作用为_________;锥形瓶中的试剂应为_______。
(2)步骤1所加入的无水AlCl3的作用为___________。
(3)步驟2中用10%NaHCO3溶液洗涤有机相,是为了除去溶于有机相的_________。
(4)步骤3中加入无水硫酸钙固体的目的是______________。
(5)步骤4中,某种技术为 _______________。
(6)本实验所得到的间溴苯甲醛的产率为_______________。


