题目内容
6.在下列物质中:①Fe ②稀硫酸 ③醋酸 ④NaOH固体 ⑤FeCl3饱和溶液 ⑥Fe(OH)3胶体 ⑦蔗糖
(1)④NaOH固体属于AC(填序号);⑥Fe(OH)3胶体属于B(填序号).
A.纯净物B.混合物C.电解质D.非电解质
(2)③醋酸与④NaOH在水溶液中反应的离子方程式为CH3COOH+OH-=CH3COO-+H2O.
(3)把①Fe投入②稀硫酸中发生反应的化学方程式为Fe+H2SO4═FeSO4+H2↑;按照交叉分类法该反应属于ABC(填序号).
A.氧化还原反应B.离子反应 C.置换反应 D.复分解反应
(4)向⑥Fe(OH)3胶体中逐滴滴加⑥稀硫酸的过程中可观察到的现象是先产生红褐色沉淀,后沉淀溶解,发生反应的离子方程式为Fe(OH)3+3H+═Fe3++3H2O.
(5)列举两种区别⑤FeCl3饱和溶液与⑥Fe(OH)3胶体的简单方法:观察分散系的颜色,用一束光照射分散系.
分析 (1)氢氧化钠只有一种物质组成;在水溶液中或者熔融状态下能导电;Fe(OH)3胶体属于含有分散质氢氧化铁与分散剂水;
(2)醋酸与氢氧化钠反应生成醋酸钠和水;
(3)铁与稀硫酸反应生成硫酸亚铁和氢气;反应中有离子参加,有化合价变化,是单质与化合物生成另一种单质和另一种化合物;
(4)胶体加入可溶性电解质会发生聚沉,氢氧化铁与硫酸会发生酸碱中和反应;
(5)依据二者颜色不同,胶体具有丁达尔效应、聚沉、电泳的性质解答.
解答 解:(1)氢氧化钠只有一种物质组成,是化合物,属于纯净物;在水溶液中或者熔融状态下能导电,是电解质;Fe(OH)3胶体属于含有分散质氢氧化铁与分散剂水,属于混合物;
故选:AC; B;
(2)醋酸与氢氧化钠反应生成醋酸钠和水,离子方程式:CH3COOH+OH-=CH3COO-+H2O;
故答案为:CH3COOH+OH-=CH3COO-+H2O;
(3)铁与稀硫酸反应生成硫酸亚铁和氢气,离子方程式:Fe+H2SO4═FeSO4+H2↑,反应中有离子参加属于离子反应,有化合价变化属于氧化还原反应,是单质与化合物生成另一种单质和另一种化合物,是置换反应;
故答案为:Fe+H2SO4═FeSO4+H2↑; A、B、C;
(4)Fe(OH)3胶体中逐滴滴加稀硫酸先发生聚沉产生红褐色沉淀,然后沉淀逐渐溶解,离子方程式:Fe(OH)3+3H+═Fe3++3H2O;
故答案为:先产生红褐色沉淀,后沉淀溶解; Fe(OH)3+3H+═Fe3++3H2O;
(5)氢氧化铁胶体为红褐色,氯化铁为棕黄色,氢氧化铁胶体具有丁达尔效应、聚沉、电泳等性质,
所以区别二者可以通过:观察分散系的颜色(棕黄色的是为⑤FeCl3饱和溶液;红褐色的是⑥Fe(OH)3胶体);用一束光照射分散系(有丁达尔效应的是⑥Fe(OH)3胶体);利用电泳实验等方法;
故答案为:观察分散系的颜色;用一束光照射分散系;
点评 本题考查了物质的分类、离子方程式的书写、胶体的性质、化学反应类型的判断,熟悉相关概念是解题关键,题目难度不大,注意对胶体性质的应用.

| A. | 同温同压下,体积相同的氢气和氩气所含的分子数相等 | |
| B. | 标准状况下22.4 L乙醇中分子数为NA | |
| C. | 在1 L 2 mol/L的盐酸中,存在2NA个氯化氢分子 | |
| D. | 1.8g的NH4+中含有的电子数为1.1NA |
| A. | 硫酸溶液与氢氧化钡溶液混合:SO${\;}_{4}^{2-}$+Ba2+═BaSO4↓ | |
| B. | 氯化钙溶液中通入CO2气体:Ca2++CO2+H2O═CaCO3↓+2H+ | |
| C. | 硫酸铜溶液中加入烧碱溶液:Cu2++2OH-═Cu(OH)2↓ | |
| D. | 碳酸钙固体上滴加醋酸溶液:CO${\;}_{3}^{2-}$+2H+═CO2↑+H2O |
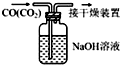
| A配置0.10mol/LNaOH溶液 | B.除去CO中的CO2 | C.苯萃取碘水中的I2分出水层后的操作 | D.记录滴定终点读数为12.20mL |
 |  |  |  |
| A. | 配制0.10mol/L NaOH溶液 | |
| B. | 除去CO中的CO2 | |
| C. | 苯萃取碘水中的I2分出水层后的操作 | |
| D. | 记录滴定终点读数为12.20mL |
 .
.