题目内容
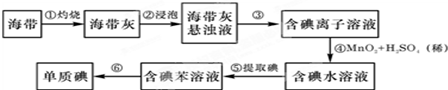
18.溴被称为“海洋元素”,海水中的溴主要以NaBr的形式存在.查阅资料得知:Br2的沸点为59℃,微溶于水,易溶于有机溶剂.实验室简单模拟从海水(此处以低浓度的NaBr溶液代替)中提取溴单质的流程如图:
(1)写出实验操作的名称,操作①萃取、分液、操作②蒸馏;
(2)在富集过程中,有反应 5NaBr+NaBrO3+3H2SO4=3Br2+3Na2SO4+3H2O,与该反应在氧化还原反应原理上最相似的是B
A.2NaBr+Cl2=2NaCl+Br2
B.2H2S+SO2=2H2O+3S↓
C.AlCl3+3NaAlO2+6H2O=4Al(OH)3↓+3NaCl
D.Cl2+2NaOH=NaCl+NaClO+H2O
(3)实验前检测分液漏斗没有问题,但在操作①的步骤中,旋开分液漏斗下端的旋塞,却发现分液漏斗中的液体很难滴下,其原因可能是没有打开分液漏斗颈上的玻璃塞(或玻璃塞上的凹槽没有与漏斗上的小孔对齐);
(4)下列说法正确的是D.
A.操作①中,可以用酒精代替CCl4
B.操作②中,若发现忘了加碎瓷片,应该趁热补加
C.操作②中,温度计水银球应浸没在蒸馏烧瓶中液体的液面以下,但不能接触瓶底
D.操作②中,冷凝水流向应该是下进上出.
分析 (1)从较高浓度的溴 水中获得溴的四氯化碳溶液,可以用四氯化碳从溴水中萃取再分液获得,分离四氯化碳和溴可以通过蒸馏的方法;
(2)反应5NaBr+NaBrO3+3H2SO4═3Br2+Na2SO4+3H2O中,只有Br元素的化合价发生变化,反应的特点为Br2既是氧化产物又是还原产物,以此解答;
(3)使用分液漏斗时应取下塞子,使分液漏斗内的压强等于大气压强,保证液体顺利流出;
(4)A.操作①为萃取,由于酒精易溶于水,所以不能用酒精做萃取剂;
B.操作②为蒸馏,若发现忘了加碎瓷片,应该等冷却后再补加;
C.操作②为蒸馏,温度计水银球应在蒸馏烧瓶的支管处;
D.操作②为蒸馏,根据逆流冷却效果好可知,冷凝水流向应该是下进上出.
解答 解:(1)从较高浓度的溴 水中获得溴的四氯化碳溶液,可以用四氯化碳从溴水中萃取再分液获得,所以操作①为萃取、分液,分离四氯化碳和溴可以通过蒸馏的方法,所以操作②为蒸馏,
故答案为:萃取、分液;蒸馏;
(2)反应5NaBr+NaBrO3+3H2SO4═3Br2+Na2SO4+3H2O中,只有Br元素的化合价发生变化,反应的特点为Br2既是氧化产物又是还原产物,
A.反应中NaBr为还原剂,Cl2为氧化剂,氧化产物与还原产物不是同种物质,故A错误;
B.只有S元素化合价变化,S既是氧化产物又是还原产物,故B正确;
C.元素化合价没有发生变化,不是氧化还原反应,故C错误;
D.氯气自身氧化还原反应,氧化产物为NaClO,还原产物为NaCl,氧化产物与还原产物不是同种物质,故D错误.
故选:B;
(3)使用分液漏斗时应取下塞子,使分液漏斗内的压强等于大气压强,保证液体顺利流出,打开分液漏斗,发现其中的液体不能流下,可能的原因是分液漏斗瓶塞未打开(或玻璃塞上的凹槽没有与漏斗上的小孔对齐),
故答案为:没有打开分液漏斗颈上的玻璃塞(或玻璃塞上的凹槽没有与漏斗上的小孔对齐);
(4)A.操作①为萃取,由于酒精易溶于水,所以不能用酒精做萃取剂,故A错误;
B.操作②为蒸馏,若发现忘了加碎瓷片,应该等冷却后再补加,故B错误;
C.操作②为蒸馏,温度计水银球应在蒸馏烧瓶的支管处,故C错误;
D.操作②为蒸馏,根据逆流冷却效果好可知,冷凝水流向应该是下进上出,故D正确;
故选D.
点评 本题结合海水提取溴的过程,考查了氧化还原反应、仪器的使用方法,在配平时抓住化合价升降总数相等,题目难度不大,注意相关基础知识的积累.


| A. | 乙醇 | B. | 盐酸 | C. | NaOH | D. | HNO3 |
| A. | ${\;}_{92}^{235}$U相对原子质量为235 | |
| B. | ${\;}_{92}^{235}$U中的中子数为92 | |
| C. | ${\;}_{92}^{235}$U与 ${\;}_{6}^{12}$C的质量比约为235:12 | |
| D. | ${\;}_{92}^{235}$U 与${\;}_{92}^{238}$U互称为同位素 |
| A. | 实验桌上的酒精灯倾倒了燃烧起来,马上用水扑灭 | |
| B. | 不慎将酸或碱液溅入眼内,立即闭上眼睛,用手揉擦 | |
| C. | 皮肤上溅有较多的浓硫酸,赶紧用水冲洗 | |
| D. | 分液时,下层液体从下端放出,上层液体从上口倒出 |
| A. | 同质量的H2与Cl2,H2的分子数一定比Cl2多 | |
| B. | 0.5mol氢的质量是0.5g | |
| C. | 摩尔是用来衡量微观粒子多少的一种物理量 | |
| D. | 0.1mol H2SO4含有氢原子数的精确值为1.204×1023 |
 .
.