题目内容
【题目】现有金属单质A、B、C、I和气体甲、乙、丙及物质D、E、F、G、H。其中B是地壳中含量最多的金属。它们之间能发生如下反应(图中有些反应的产物和反应的条件没有全部标出)。
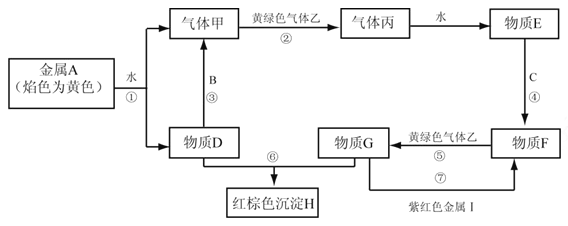
请根据以上信息回答下列问题:
(1)写出下列物质的化学式: C 、H
(2)写出反应③的化学方程式: 写出反应⑦的离子方程式:
(3)实验室检验物质G中阳离子的常用试剂是: 实验室检验物质D中阳离子的方法是
(4)写出物质D溶液加入物质F溶液中反应的离子方程式 ;该物质露置空气中发生反应的化学方程式 。
【答案】(1)FeFe(OH)3
(2)反应③:2Al+2NaOH+2H2O==2NaAlO2+3H2↑(2分)
反应⑦:2Fe3++Cu==2Fe2++Cu2+(2分)
(3)KSCN或NaOH溶液(其他合理答案亦可)(2分),焰色反应(2分)
(4)Fe2++2OH-=Fe(OH)2↓;4Fe(OH)2+O2+2H2O=4Fe(OH)3(各2分)
【解析】
试题分析:金属A的焰色反应是黄色,说明A是钠,钠和水反应生成氢气和氢氧化钠,则D是氢氧化钠,甲是氢气,黄绿色气体应该是氯气,即乙是氯气,所以丙是氯化氢,E是盐酸,能和氢氧化钠反应生成氢气的金属应该是铝,即B是铝,红褐色沉淀H应该是氢氧化铁,所以G是氯化铁,则F是氯化亚铁,所以金属C是铁,紫红色金属I是铜。
(1)根据上述分析,C、H分别为铁和氢氧化铁,化学式为Fe、Fe(OH)3 .
(2)反应③是铝与NaOH溶液反应生成偏铝酸钠和氢气,化学方程式为2Al+2NaOH+2H2O == 2NaAlO2+ 3H2↑;反应⑦是铜与氯化铁反应生成氯化亚铁和氯化铜,离子方程式为2Fe3++Cu==2Fe2++Cu2+。
(3)根据上述分析,物质G为氯化铁,检验Fe3+的常用试剂是KSCN或NaOH溶液;物质D为氢氧化钠,检验Na+常用的方法是焰色反应。
(4)根据上述分析,物质D为NaOH,F为氯化亚铁,两者反应生成氯化亚铁白色沉淀,离子方程式为Fe2+ + 2OH- =Fe(OH)2↓;氢氧化亚铁不稳定,露置在空气中会被氧气氧化成红褐色的氢氧化铁,化学反应方程式为4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3。

 轻巧夺冠周测月考直通中考系列答案
轻巧夺冠周测月考直通中考系列答案