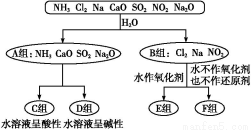
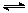题目内容
向甲、乙两恒温恒容的密闭容器中,分别充入一定量的A和B,发生反应:A(g)+B(g)  xC(g) △H<0。测得两容器中c(A)随时间t的变化如图所示:
xC(g) △H<0。测得两容器中c(A)随时间t的变化如图所示:

容器 | 甲 | 乙 |
容积(L) | 0.5 | 0.5 |
反应放热(kJ) | Q1 | Q2 |
反应物起始量 | 1 molA 1 molB | 0.5 molA 0.5 molB |
下列说法正确的是
A.x=1
B.Q1>2Q2
C.根据题中信息无法计算a值
D.保持其他条件不变,起始时向乙容器充入0.2 mol A、0.2 mol B、0.2 mol C,则此时v(正)> v(逆)
AB
【解析】
试题分析:根据图表数据可知容器体积为0.5L,当投料量A是1mol时和0.5mol时,达到平衡后前者不是后者的两倍,且平衡时甲中A浓度小于1mol/L。可以说明x不等于2,且气体体积减小,所以x=1,且两者也不是等效平衡。由甲中A的转化量大于一半即转化量多于0.5mol,乙中A的转化量等于50%,即转化了0.25mol,可知放出的热量Q1>2Q2 ,B正确。由于两个反应在相同条件下,平衡常数相同,通过三态法可计算出a的值。根据乙在t2时的平衡量关系,求出平衡常数K=2,根据D中数据Q=0.4/0.4*0.4=2.5>2,说明反应向逆向移动,v(正)< v(逆),错误。
考点:本题考查化学平衡的移动和化学反应热问题。

练习册系列答案
 快乐5加2金卷系列答案
快乐5加2金卷系列答案
相关题目