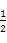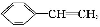题目内容
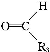
下列与有机物的结构、性质有关的叙述正确的是( )
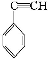
A.苯、油脂均不能使酸性KMnO4溶液褪色
B.甲烷和Cl2的反应与乙烯和Br2的反应属于同一类型的反应
C.葡萄糖、果糖的分子式均为C6H12O6,两者互为同分异构体
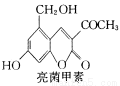
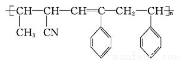
D.乙醇、乙酸均能与Na反应放出H2,两者分子中官能团相同
C
【解析】油脂能被酸性KMnO4溶液氧化,A错误;B.前者为取代反应,后者为加成反应,错误;C正确;D.前者含醇羟基,后者含羧基,错误。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案草酸亚铁(FeC2O4·2H2O)用作分析试剂及显影剂和新型电池材料磷酸亚铁锂的生产。已知:CO能与氯化钯(PdCl2)溶液反应生成黑色的钯粉。回答下列问题:
Ⅰ:兴趣小组对草酸亚铁的分解产物进行实验和探究。
(1)将气体产物依次通过A、澄清石灰水,B、氯化钯,观察到A中澄清石灰水变浑浊,B中有黑色物质生成,则上述现象说明气体产物中有 。
(2)探究分解得到的固体产物中铁元素的存在形式。
①提出假设
假设1: ; 假设2:FeO; 假设3:FeO和Fe的混合物。
②设计实验方案证明假设3。
限选试剂:1.0 mol·L-1盐酸、3% H2O2溶液、0.1 mol·L-1CuSO4溶液、20% KSCN溶液、蒸馏水。
实验步骤 | 现象与结论 |
步骤1:向试管中加入少量固体产物,再加入足量 ,充分振荡 | 若溶液颜色明显改变,且有 生成,则证明有铁单质存在 |
步骤2:将步骤1中得到的浊液过滤,并用蒸馏水洗涤至洗涤液无色 |
|
步骤3:取步骤2得到的少量固体于试管中,滴加 |
|
Ⅱ:某草酸亚铁样品中含有少量草酸。现用滴定法测定该样品中FeC2O4的含量。滴定反应是:5Fe2+ +5C2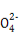 +3Mn
+3Mn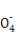 +24H+
+24H+ 5Fe3+ +10CO2↑+3Mn2++12H2O实验方案设计为:
5Fe3+ +10CO2↑+3Mn2++12H2O实验方案设计为:
①将准确称量的0.20 g草酸亚铁样品置于250 mL锥形瓶内,加入适量2 mol/L的H2SO4溶液,使样品溶解,加热至70 ℃左右,立即用浓度为0.020 00 mol/L的高锰酸钾标准溶液滴定至终点,记下滴定管内液面读数为V1 mL。
②向上述滴定混合液中加入适量的Zn粉和过量的2 mol/L的H2SO4溶液,煮沸5~8 min,用KSCN溶液在点滴板上检验点滴液,直至溶液不立刻变红。将滤液过滤至另一个锥形瓶中,继续用0.020 00 mol/L的高锰酸钾标准溶液滴定至终点,记下滴定管内液面读数为V2 mL。
③重复以上实验1~2次。
若某小组的一次测定数据记录如下:V1= 18.90 mL,V2=6.20 mL。根据数据计算0.20 g 样品中:n(Fe2+)= ; n(C2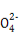 )= ;FeC2O4 的质量分数为 (精确到0.01%)。
)= ;FeC2O4 的质量分数为 (精确到0.01%)。
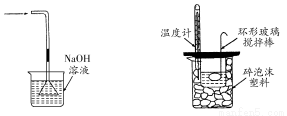
某化学探究小组欲对SO2的化学性质进行如下探究,请你帮助他完成实验报告。
物质 | 类别 | 化学性 质预测 | 实验验证 | ||
实验操作 | 实验现象 | 实质(用离子 方程式表示) | |||
二氧 化硫 | 酸性 氧化物 | 与水 反应 | 将盛满SO2气体的试管倒立在水中,并测定试管中溶液的pH | ① | SO2+H2O
|
与碱 反应 | ② | 出现白 色沉淀 | ③ | ||
(2)该探究小组还根据SO2中S元素的化合价,预测并通过实验探究SO2的其他性质。探究过程中选用的实验药品有:浓硫酸、亚硫酸钠固体、Na2S溶液、酸性高锰酸钾溶液、品红溶液等。探究过程的实验装置图如图所示,请回答下列问题。
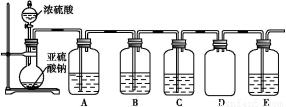
①请你完成下列表格。
装置 | 药品 | 作用 |
A |
| 验证二氧化硫的还原性 |
B |
|
|
C | 品红溶液 |
|
②A中发生反应的离子方程式为 。
③实验时C中的实验现象是 。
④D装置的作用是 。E是尾气处理装置,有人认为E装置中可以加入足量的Ba(NO3)2溶液,你认为是否合理,请结合离子方程式加以说明: 。
向甲、乙两恒温恒容的密闭容器中,分别充入一定量的A和B,发生反应:A(g)+B(g)  xC(g) △H<0。测得两容器中c(A)随时间t的变化如图所示:
xC(g) △H<0。测得两容器中c(A)随时间t的变化如图所示:

容器 | 甲 | 乙 |
容积(L) | 0.5 | 0.5 |
反应放热(kJ) | Q1 | Q2 |
反应物起始量 | 1 molA 1 molB | 0.5 molA 0.5 molB |
下列说法正确的是
A.x=1
B.Q1>2Q2
C.根据题中信息无法计算a值
D.保持其他条件不变,起始时向乙容器充入0.2 mol A、0.2 mol B、0.2 mol C,则此时v(正)> v(逆)