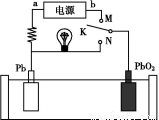
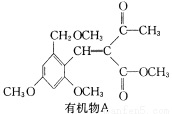
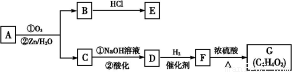
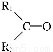
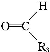
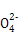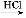题目内容
以下是依据一定的分类标准,对某些物质与水反应情况进行分类的图示。
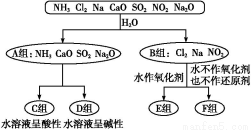
请根据你所学的知识,按要求填空:
(1)上述第一级分类标准(分成A、B组的依据)是 。
(2)F组中物质除了Cl2外还有 (填化学式)。
(3)A组中的CaO经常用作食品包装袋中的干燥剂,CaO所属的物质类型为 (用序号填空)。
①金属氧化物;②碱性氧化物;③碱;④碱性干燥剂
CaO可作干燥剂的理由是 (用化学方程式表示)。
(4)D组中NH3的水溶液呈弱碱性,用电离方程式表示其呈弱碱性的原因: 。
(5)由Al3+制备Al(OH)3,最好不选择D组中的NaOH溶液,说明理由: 。
(1)是否发生氧化还原反应 (2)NO2
(3)①②④ CaO+H2O Ca(OH)2
Ca(OH)2
(4)NH3·H2O N
N +OH-
+OH-
(5)过量NaOH溶液会溶解生成的Al(OH)3沉淀
【解析】(1)分析A、B两组物质与水的反应情况可知第一级分类标准是是否发生氧化还原反应。
(2)Cl2、NO2与水反应时,水既不作氧化剂也不作还原剂。
(3)CaO能与水反应,吸收水蒸气,故①②④正确。
(4)D组中NH3的水溶液呈弱碱性的原因是:NH3·H2O发生电离:NH3·H2O N
N +OH-,产生OH-。
+OH-,产生OH-。
(5)由Al3+制备Al(OH)3,最好不选择NaOH溶液,因为过量NaOH溶液会溶解生成的Al(OH)3沉淀。

 阅读快车系列答案
阅读快车系列答案草酸亚铁(FeC2O4·2H2O)用作分析试剂及显影剂和新型电池材料磷酸亚铁锂的生产。已知:CO能与氯化钯(PdCl2)溶液反应生成黑色的钯粉。回答下列问题:
Ⅰ:兴趣小组对草酸亚铁的分解产物进行实验和探究。
(1)将气体产物依次通过A、澄清石灰水,B、氯化钯,观察到A中澄清石灰水变浑浊,B中有黑色物质生成,则上述现象说明气体产物中有 。
(2)探究分解得到的固体产物中铁元素的存在形式。
①提出假设
假设1: ; 假设2:FeO; 假设3:FeO和Fe的混合物。
②设计实验方案证明假设3。
限选试剂:1.0 mol·L-1盐酸、3% H2O2溶液、0.1 mol·L-1CuSO4溶液、20% KSCN溶液、蒸馏水。
实验步骤 | 现象与结论 |
步骤1:向试管中加入少量固体产物,再加入足量 ,充分振荡 | 若溶液颜色明显改变,且有 生成,则证明有铁单质存在 |
步骤2:将步骤1中得到的浊液过滤,并用蒸馏水洗涤至洗涤液无色 |
|
步骤3:取步骤2得到的少量固体于试管中,滴加 |
|
Ⅱ:某草酸亚铁样品中含有少量草酸。现用滴定法测定该样品中FeC2O4的含量。滴定反应是:5Fe2+ +5C2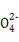 +3Mn
+3Mn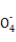 +24H+
+24H+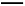 5Fe3+ +10CO2↑+3Mn2++12H2O实验方案设计为:
5Fe3+ +10CO2↑+3Mn2++12H2O实验方案设计为:
①将准确称量的0.20 g草酸亚铁样品置于250 mL锥形瓶内,加入适量2 mol/L的H2SO4溶液,使样品溶解,加热至70 ℃左右,立即用浓度为0.020 00 mol/L的高锰酸钾标准溶液滴定至终点,记下滴定管内液面读数为V1 mL。
②向上述滴定混合液中加入适量的Zn粉和过量的2 mol/L的H2SO4溶液,煮沸5~8 min,用KSCN溶液在点滴板上检验点滴液,直至溶液不立刻变红。将滤液过滤至另一个锥形瓶中,继续用0.020 00 mol/L的高锰酸钾标准溶液滴定至终点,记下滴定管内液面读数为V2 mL。
③重复以上实验1~2次。
若某小组的一次测定数据记录如下:V1= 18.90 mL,V2=6.20 mL。根据数据计算0.20 g 样品中:n(Fe2+)= ; n(C2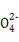 )= ;FeC2O4 的质量分数为 (精确到0.01%)。
)= ;FeC2O4 的质量分数为 (精确到0.01%)。
向甲、乙两恒温恒容的密闭容器中,分别充入一定量的A和B,发生反应:A(g)+B(g) 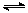 xC(g) △H<0。测得两容器中c(A)随时间t的变化如图所示:
xC(g) △H<0。测得两容器中c(A)随时间t的变化如图所示:

容器 | 甲 | 乙 |
容积(L) | 0.5 | 0.5 |
反应放热(kJ) | Q1 | Q2 |
反应物起始量 | 1 molA 1 molB | 0.5 molA 0.5 molB |
下列说法正确的是
A.x=1
B.Q1>2Q2
C.根据题中信息无法计算a值
D.保持其他条件不变,起始时向乙容器充入0.2 mol A、0.2 mol B、0.2 mol C,则此时v(正)> v(逆)