题目内容
【题目】氢气是一种新型的绿色能源,又是一种重要的化工原料。以生物材质(以C 计)与水蒸气反应制取H2是一种低耗能,高效率的制H2方法。该方法由气化炉制造H2和燃烧炉再生CaO两步构成。气化炉中涉及到的反应为:
I.C(s)+H2O(g)![]() CO(g)+H2(g) K1;
CO(g)+H2(g) K1;
Ⅱ.CO(g)+H2O(g)![]() CO2(g)+H2(g) K2;
CO2(g)+H2(g) K2;
Ⅲ.CaO(s)+CO2(g)![]() CaCO3(s) K3;
CaCO3(s) K3;
(1)该工艺制H2总反应可表示为C(s)+2H2O(g)+CaO(s)![]() CaCO3(s)+2H2(g),其反应的平衡常数K=_______________(用K1、K2、K3的代数式表示)。在2L的密闭容器中加入一定量的C(s)、H2O(g)和CaO(s)。下列能说明反应达到平衡状态的是__________。
CaCO3(s)+2H2(g),其反应的平衡常数K=_______________(用K1、K2、K3的代数式表示)。在2L的密闭容器中加入一定量的C(s)、H2O(g)和CaO(s)。下列能说明反应达到平衡状态的是__________。
a.容器内混合物的质量不变 b.H2与H2O(g)的物质的量之比不再变化
c.混合气体的密度不再变化 d.形成 a mol H-H键的同时断裂 2 amol H-O键
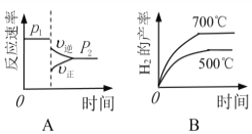
(2)对于反应Ⅰ,不同温度和压强对H2产率影响如下表。
压强 温度 | p1/Mpa | p2/Mpa |
500℃ | 45.6% | 51.3% |
700℃ | 67.8% | 71.6% |
由表中数据判断:p1 ______ p2(填“>”、“<”或“=”)
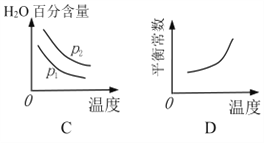
下列图像正确的是_________。
(3)已知反应Ⅱ的△H= -41.1 kJ/mol, C=O、O-H、H-H的键能分别为803kJ/mol,464 kJ/mol、436 kJ/mol,则 CO中碳氧键的键能为___________ kJ/mol。
(4)对于反应Ⅲ,若平衡时再充入CO2,使其浓度增大到原来的2倍,则平衡向_____________(填“正反应”、“逆反应”)方向移动;当重新平衡后,CO2浓度_________(填“变大”、“变小”或“不变”)。
【答案】 K1·K2·K3 bc > BD 1072.9 正反应 不变。
【解析】(1)①已知:I:C(s)+H2O(g)═CO(g)+H2(g) K1,Ⅱ:CO(g)+H2O(g)═CO2(g)+H2(g)K2,Ⅲ:CaO(s)+CO2(g)═CaCO3(s)K3,反应I、II、III之和为反应C(s)+2H2O(g)+CaO(s)═CaCO3(s)+2H2(g),则K=K1K2K3;a.根据质量守恒定律,容器内混合物的质量始终不变,不能判断达到平衡状态,错误;b.H2与H2O(g)的物质的量之比不再变化,说明正逆反应速率相等,能够判断达到了平衡状态,正确;
c.C为固体,反应后气体的质量增大,溶液的体积不变,则混合气体的密度不再变化,能够判断达到了平衡状态,正确;d.形成 a mol H-H键的同时断裂 2 amol H-O键描述的都是正反应速率,不能判断达到了平衡状态,错误;故选bc,故答案为:K1K2K3;bc;
(2)根据反应Ⅰ、C(s)+H2O(g)![]() CO(g)+H2(g) K1;相同温度条件下,减小压强,平衡正向移动,氢气的产率增大,因此p1 > p2;A.减小压强,平衡正向移动,与图像不符,错误;B.根据表格数据,升高温度,氢气的产率增大,说明平衡正向移动,与图像吻合,正确;C.升高温度,平衡正向移动,水的含量减少,降低压强,平衡正向移动,水的含量减少,与图像不符,错误;D.升高温度,平衡正向移动,平衡常数增大,与图像吻合,正确,故选BD,故答案为:>;BD;
CO(g)+H2(g) K1;相同温度条件下,减小压强,平衡正向移动,氢气的产率增大,因此p1 > p2;A.减小压强,平衡正向移动,与图像不符,错误;B.根据表格数据,升高温度,氢气的产率增大,说明平衡正向移动,与图像吻合,正确;C.升高温度,平衡正向移动,水的含量减少,降低压强,平衡正向移动,水的含量减少,与图像不符,错误;D.升高温度,平衡正向移动,平衡常数增大,与图像吻合,正确,故选BD,故答案为:>;BD;
(3)设CO中碳氧键的键能x kJ/mol,反应ⅡCO(g)+H2O(g)![]() CO2(g)+H2(g)△H= -41.1 kJ/mol=反应物的键能之和-生成物的键能之和=(x+464×2)-(803×2+436),解得x=1072.9,故答案为:1072.9;
CO2(g)+H2(g)△H= -41.1 kJ/mol=反应物的键能之和-生成物的键能之和=(x+464×2)-(803×2+436),解得x=1072.9,故答案为:1072.9;
(4)反应ⅢCaO(s)+CO2(g)![]() CaCO3(s),若平衡时再充入CO2,使其浓度增大到原来的2倍,相当于增大压强,平衡正向移动;温度不变,平衡常数不变,K=
CaCO3(s),若平衡时再充入CO2,使其浓度增大到原来的2倍,相当于增大压强,平衡正向移动;温度不变,平衡常数不变,K=![]() 不变,则重新平衡后,CO2浓度不变,故答案为:正反应;不变。
不变,则重新平衡后,CO2浓度不变,故答案为:正反应;不变。

 提分百分百检测卷系列答案
提分百分百检测卷系列答案 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案【题目】磷化铝(AlP)通常可作为一种广谱性熏蒸杀虫剂,吸水后会立即产生高毒的PH3气体(熔点为-132℃,还原性强)。卫生安全标准规定:当粮食中磷化物(以PH3计)的含量不超过0.05mg·kg-1时,粮食质量合格;反之,粮食质量不合格。某化学兴趣小组的同学通过下列方法对粮食中残留的磷化物含量进行了研究。
【操作流程】
安装吸收装置→PH3的产生与吸收→转移KMnO4吸收溶液→亚硫酸钠标准溶液滴定。
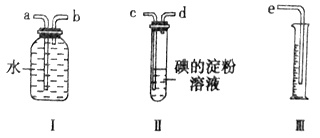
【实验装置】
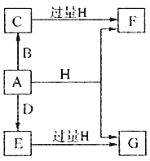
已知 C 中盛有 100 g原粮,E 中盛有 20.00 mL 1.13×10-3 mol L-1KMnO4溶液(H2SO4酸化)。请回答下列问题:

(1)仪器D的名称是____________________________。
(2)B中盛有焦性没食子酸的碱性溶液,其作用是吸收空气中的O2,防止氧化装置C中生成的PH3,则A中盛装KMnO4溶液的作用是_________________________。
(3)已知MnO4-被还原为Mn2+,若0.1mol PH3恰好被0.16mol KMnO4吸收,则PH3被氧化的产物是__________,写出E中发生反应的离子方程式:_________________________
(4)收集E中吸收液,加水稀释至250mL,取25.00mL于锥形瓶中,用5.0×10-4mol L-1的Na2SO3标准溶液滴定剩余的KMnO4溶液:
三次实验消耗V标 | 1 | 2 | 3 |
mL | 11.02 | 11.30 | 10.98 |
①滴定达到终点的现象是:________________________________。
②数据处理:消耗Na2SO3标准溶液____mL;则该原粮中磷化物(以PH3计)的含量为______________________mg kg-1。
③若C中反应完全后,忘记通入空气即进行(4)中的滴定操作,则消耗Na2SO3标准溶液的体积____________(选填“偏大”、“偏小”或“不变”)