题目内容
8.能用CO32-+2H+=H2O+CO2↑离子方程式表示的反应是( )| A. | CaCO3+2HCl=CaCl2+H2O+CO2↑ | B. | NaHCO3+HNO3=NaNO3+H2O+CO2↑ | ||
| C. | Na2CO3+H2SO4=Na2SO4+H2O+CO2↑ | D. | BaCO3+H2SO4=BaSO4↓+H2O+CO2↑ |
分析 CO32-+2H+═H2O+C02↑表示可溶性的碳酸盐与强酸反应生成可溶性盐的一类反应,据此解答.
解答 解:A.石灰石为碳酸钙,碳酸钙为难溶物,离子方程式中需要保留化学式,该反应的离子方程式不能用CO32-+2H+═H2O+C02↑表示,故A错误;
B.碳酸氢钠为弱酸的酸式盐,碳酸氢根离子不能拆,该反应的离子方程式不能用CO32-+2H+═H2O+C02↑表示,故B错误;
C.硫酸与碳酸钠反应,为可溶性强酸与可溶性碳酸盐反应生成产物硫酸钠为易溶性盐,离子方程式:CO32-+2H+=H2O+CO2↑,故C正确;
D.碳酸钡为沉淀,离子方程式中需要保留化学式,该反应的离子方程式不能用CO32-+2H+═H2O+C02↑表示,故D错误;
故选:C.
点评 本题考查了离子方程式的判断,明确反应实质及化学式拆分原则是解题关键,要求熟悉常见的难溶物、弱电解质、气体,题目难度不大.

练习册系列答案
 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案
相关题目
19.实验室制备氯气:4HCl(浓)+MnO₂═MnCl₂+Cl₂↑+2H₂O,
下列说法正确的是( )
下列说法正确的是( )
| A. | 氧化剂和还原剂的物质的量之比为4:1 | |
| B. | Cl₂即是氧化产物又是还原产物 | |
| C. | 转移2mol电子时,得到标准状况下的氯气为11.2L | |
| D. | 该反应的离子方程式:MnO2+4H++2Cl-=Mn2++Cl2↑+2H2O |
16.在体积一定的密闭容器中给定物质A、B、C的量,在一定条件下发生反应建立的化学平衡:aA(g)+bB(g)?xC(g),符合下图所示的关系(c%表示平衡混合气中产物C的百分含量,T表示温度,p表示压强).在图中,Y轴是指( )
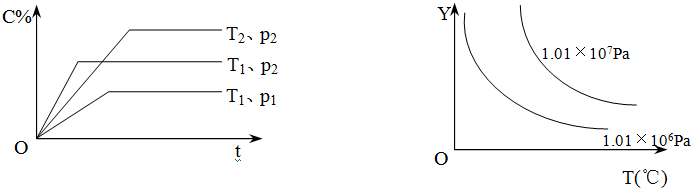
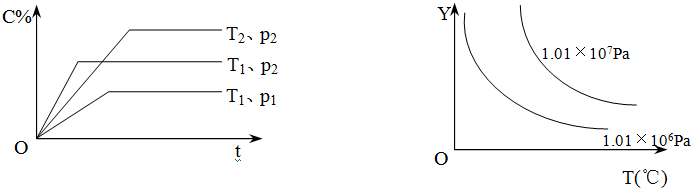
| A. | 反应物A的转化率 | B. | 平衡混合气中物质B的百分含量 | ||
| C. | 平衡混合气的密度 | D. | 该反应的正方向的△H>0 |
3.在一定温度下的定容密闭容器中,以下说法能表明反应:A(s)+2B(g)?C(g)+D(g)已达平衡的是( )
| A. | 混合气体的压强不变 | B. | 混合气体的密度变小 | ||
| C. | 每消耗2molB,同时消耗1molC | D. | C和D的浓度比不变 |
20.下列物质属于弱电解质的是( )
| A. | H20 | B. | 盐酸 | C. | Cu | D. | NaCl |
18.下列关于有机化合物的说法正确的是( )
| A. | 乙烯使KMnO4酸性溶液褪色是因为发生了氧化反应 | |
| B. | 甲烷和乙烯都可以与溴水反应 | |
| C. | 高锰酸钾可以氧化苯和甲烷 | |
| D. | 乙烯可以与氢气发生加成反应,苯也能与氢气加成 |
