题目内容
下列事实不能说明醋酸是弱电解质的是( )
| A.0.1 mol·L-1醋酸的pH比0.1 mol·L-1盐酸的pH大 |
| B.醋酸能和碳酸钙反应放出CO2 |
| C.0.1 mol·L-1醋酸钠溶液的pH=8.9 |
| D.大小相同的锌粒分别与相同物质的量浓度的盐酸和醋酸反应,醋酸产生H2速率慢 |
B
解析

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列各溶液中,叙述正确的是
| A.0.1mol/L的(NH4)2SO4溶液中:c(SO42-)>c(NH4+)>c(H+)>c(OH-) |
| B.25℃时,将pH=3的盐酸溶液和pH=11的氨水等体积混合后,溶液中离子浓度的大小关系:c(Cl-)>c(NH4+)>c(OH-)>c(H+) |
| C.将0.1mol/L醋酸溶液加大量水稀释后,溶液的pH增大 |
| D.Na2CO3溶液中:c(Na+ )="2c" (CO32- ) + c (HCO3- ) + c (H2CO3 ) |
常温下,Ksp(CaSO4)=9´10-6,常温下CaSO4在水中的沉淀溶解平衡曲线见图。下列说法正确的是( )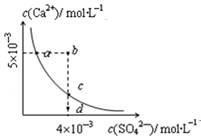
| A.在任何溶液中,c(Ca2+)、c(SO42-)均相等 |
| B.d点溶液通过蒸发可以变到c点 |
| C.a点对应的Ksp等于c点对应的Ksp |
| D.b点将有沉淀生成,平衡后溶液中c(SO42-)一定等于4´10-3 mol·L-1 |
常温下,浓度均为0.1mol/L CH3COOH溶液和HCN溶液的pH分别为m和n(1<m<n)。
下列叙述中不正确的是
| A.常温下,pH相同的CH3COOH溶液和HCN溶液分别加水稀释相同的倍数时,前者pH变化小 |
| B.等温下,等浓度的CH3COONa和NaCN溶液pH,后者大 |
| C.HCN溶液和NaOH溶液不等体积混合后一定存在C(H+)―C(OH-)=C(CN-)―C(Na+) |
| D.溶液中由水电离出的C(H+),前者是后者的10m-n倍 |
室温下,将1.000 mol·L-1盐酸滴入20.00 mL 1.000 mol·L-1氨水中,溶液pH和温度随加入盐酸体积变化曲线如图所示。下列有关说法正确的是( )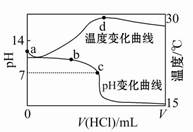
| A.a点由水电离出的c(H+)=1×10-14 mol/L |
| B.b点:c(NH4+)+c(NH3·H2O)=c(Cl-) |
| C.c点:c(Cl-)=c(NH4+) |
| D.d点后,溶液温度略下降的主要原因是NH3·H2O电离吸热 |
常温下,0.1 mol·L-1 HX溶液的pH=1,0.1 mol·L-1 CH3COOH溶液的pH=2.9。下列说法不正确的是 ( )。
| A.HX和CH3COOH均可抑制水的电离 |
| B.取HCl与HX各0.1 mol溶于水配制成1 L混合溶液,则溶液的c(H+)=0.2 mol·L-1 |
| C.等物质的量浓度、等体积的HX溶液与CH3COONa溶液混合后所得的溶液中:c(Na+)>c(CH3COOH)>c(CH3COO-)>c(H+)>c(OH-) |
| D.向等物质的量浓度、等体积的HX溶液和CH3COOH溶液中,分别加入一定物质的量浓度的NaOH溶液,欲使两者的pH均等于7,则消耗氢氧化钠溶液的体积:前者大于后者 |
25 ℃时,关于浓度均为0.2 mol/L的Na2CO3和NaHCO3溶液的说法不正确的是( )
| A.两溶液中均存在电离平衡和水解平衡 |
| B.两溶液分别加水稀释后,pH和KW均减小 |
| C.两溶液中均存在c(OH-)+2c(CO32—)+c(HCO3—)=c(Na+)+c(H+) |
| D.c(OH-)前者大于后者 |
向0.1 mol/L的CH3COOH溶液中加水或加入少量CH3COONa晶体时,下列有关叙述不正确的是( )
| A.都能使溶液的pH增加 |
| B.都能使溶液中c(H+)·c(CH3COO-)增大 |
C.都能使溶液中 比值增大 比值增大 |
| D.溶液中c(H+)·c(OH-)不变 |
常温下,0.1 mol/L氨水溶液中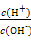 =1×10-8,下列叙述不正确的是( )
=1×10-8,下列叙述不正确的是( )
| A.该溶液中氢离子的浓度:c(H+)=1×10-11 mol/L |
B.0.1 mol/L氨水溶液与0.1 mol/L HCl溶液等体积混合后所得溶液中:c(N )+c(H+)=c(Cl-)+c(OH-) )+c(H+)=c(Cl-)+c(OH-) |
C.0.1 mol/L的氨水溶液与0.05 mol/L H2SO4溶液等体积混合后所得溶液中:c(N )+c(NH3)+c(NH3·H2O)=2c(S )+c(NH3)+c(NH3·H2O)=2c(S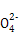 ) ) |
D.浓度均为0.1 mol/L的NH3·H2O和NH4Cl溶液等体积混合后,若溶液呈碱性,则c(N )>c(NH3·H2O)>c(Cl-)>c(OH-)>c(H+) )>c(NH3·H2O)>c(Cl-)>c(OH-)>c(H+) |