题目内容
(13分)短周期元素Q、R、T、W在元素周期表中的位置如右图所示,其中T所处的周期序数与主族序数相等,请回答下列问题: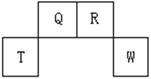
(1)W在周期表中的位置是 , Q、R、T三种元素原子的半径从大到小排列顺序 (用元素符号表示),Q的最高价氧化物的电子式 ,R气态氢化物分子的结构式为 ;
(2)元素的原子得电子能力:Q W(填“强于”或“弱于”);
(3)原子序数比R多8的元素形成的一种常见气态氢化物的沸点 (填“高”或“低”)于R的的常见气态氢化物;
(4)T、Q、R、W的单质中,固态时属于原子晶体的是 (填名称);
(5)现有8种元素的性质、数据如下表所列,它们属于短周期:请指出R元素在下表中的对应编号 ,与T同周期且最高价氧化物的水化物碱性最强的元素在下表中的对应编号 。
| | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
| 原子半径(10-10m) | 0.74 | 1.60 | 1.52 | 1.10 | 0.99 | 1.6 | 0.75 | 0.82 |
| 最高或最低化合价 | | +2 | +1 | +5 | +7 | +1 | +5 | +3 |
| -2 | | | -3 | -1 | | -3 | |
(1)第3周期ⅥA族(2分) Al>C>N (用元素符号表示)(2分) (2分)
(2分) 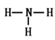 (2分) (2)弱于(1分) (3)低(1分)
(2分) (2)弱于(1分) (3)低(1分)
(4)金刚石(填名称)(1分) (5)⑦(1分) ⑥(1分)
解析试题分析:图中所示是短周期元素Q、R、T、W在元素周期表中的位置,因为T所处的周期序数与主族族序数相等,所以可以知道T是Al,则Q是C,R是N,W是S,则
(1)硫元素的原子序数是16,在周期表中的位置是第三周期第ⅥA族;同周期自左向右原子半径逐渐减小,同主族自上而下原子半径逐渐增大,则Q、R、T三种元素原子的半径从大到小排列顺序Al>C>N。碳元素的最高价氧化物是CO2,含有极性键的共价化合物,电子式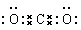 。氮元素气态氢化物分子是氨气,其结构式为
。氮元素气态氢化物分子是氨气,其结构式为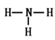 ;
;
(2)同周期自左向右非金属性逐渐增强,同主族自上而下非金属性逐渐减弱,则元素的原子得电子能力:碳元素弱于硫元素;
(3)原子序数比R多8的元素是磷元素,形成的一种常见气态氢化物是PH3,由于氨气分子间存在氢键,因此PH3的沸点低氨气的沸点;
(4)T、Q、R、W的单质中,固态时属于原子晶体的是金刚石;
(5)①没有最高价、只有最低价-2,可推知①为O;③⑥都有最高价+1,处于ⅠA族,且⑥的原子半径较大,故③为Li、⑥为Na;②有最高价+2,处于ⅡA族,原子半径大于Li,故②为Mg;④⑦都有最高价+5、最低价-3,处于ⅤA族,且④的原子半径较大,故④为P、⑦为N;⑤有最高价+7、最低价-1,则⑤为Cl;⑧只有最高价+3,处于ⅢA族,原子半径小于P,故⑧为B,因此氮元素在下表中的对应编号是⑦,与T同周期且最高价氧化物的水化物碱性最强的元素是钠,在下表中的对应编号是⑥。
考点:考查元素周期表的结构和元素周期律的应用

 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案(1)锂电池负极材料晶体为Li+嵌入两层石墨层中导致石墨堆积方式发生改变,上下层一样,形成如图晶体结构。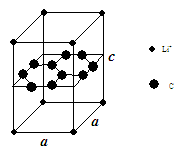
化学式为 ,该电池负极放电方程式为 。
Li+投影在石墨层图,试在图中标出与该离子邻近的其它六个Li+的投影位置。
Li+与相邻石墨六元环作用力属何种键型? 。
(2)石墨中键角为 ,C原子杂化方式为 ;实验测得石墨、苯和乙烯分子中C-C键键长依次为142、140、133 pm。请对上述系列中键长依次递减的现象作出合理的解释 。
(3)第ⅡA金属碳酸盐分解温度如下:
| | BeCO3 | MgCO3 | CaCO3 | SrCO3 | BaCO3 |
| 分解温度 | 100℃ | 540℃ | 960℃ | 1289℃ | 1360℃ |
写出BeCO3分解的化学方程式 。
分解温度为什么越来越高? 。