题目内容
[化学——选修3: 物质结构与性质](15分)
Sn是人类最早使用的元素之一,能形成SnCl2,SnCl4两种氯化物,SnCl2常温下为白色晶体,具有一维链状的聚合结构,气态时以单分子形式存在,而SnCl4常温下为无色液体。白锡和灰锡是Sn的两种同素异形体,白锡的晶体结构中Sn原子的配位数为4和6,灰锡的晶体结构与金刚石的晶体结构相似。白锡的密度大于灰锡的密度。
(1)Sn元素价层电子排布式为 。
(2)SnCl2的一维链状聚合结构如图所示,在分子结构中标出
所含有的配位键。其固体分子及气体分子中Sn的杂化方式为 。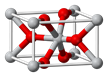
(3)SnCl4分子的空间构型为 ,SnCl4与CCl4中
沸点较高的是 。
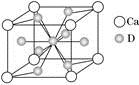
(4)锡的某种氧化物的晶胞如右图,其化学式为 。
(5)解释白锡分子的密度大于灰锡的密度的原因: 。
(6)若灰锡的晶胞边长为a pm,计算灰锡的密度 为 。
(1)5s25p2(2分)
(2) 图略 (2分) sp3、、 sp2(各1分)
(3)正四面体;SnCl4(各1分)
(4)SnO2(2分)
(5)配位数大,空间利用率大(2分)
(6)952/NA(a×10—10)3(3分)
解析试题分析:(1)Sn元素是50号元素,最外层电子是4个,位于元素周期表的第五周期,第四主族,所以价层电子排布式为5s25p2;
(2)Sn元素的5p轨道上有空轨道,Cl原子中有孤对电子,所以1个SnCl2分子中的Sn与另一分子中的Cl原子可以形成配位键,从而形成一维链状聚合结构,配位键的形式是从提供孤对电子的一方指向提供空轨道的一方;固体分子SnCl2中存在一个配位键,所以Sn的价层电子对数是3+1/2(4-2×1)=4,所以是sp3杂化;气态时以单分子形式存在,所以Sn的价层电子对数是2+1/2(4-2×1)=3, sp2杂化;
(3)SnCl4分子中Sn的价层电子对数是4+1/2(4-4×1)=4,空间构型是正四面体型;SnCl4与CCl4都是分子晶体,所以相对分子质量大的分子间作用力大,沸点较高,所以SnCl4的沸点较高;
(4)锡的某种氧化物的晶胞中Sn原子8顶点各1个和中心1个,共是8×1/8+1=2个,O原子分别在上下2个底面各2个和体内的2个,共是4×1/2+2=4,所以Sn与O的原子个数比是2:4=1:2,化学式为SnO2
(5)白锡的晶体结构中Sn原子的配位数为4和6,灰锡的晶体结构与金刚石的晶体结构相似,配位数是4,所以白锡晶体的配位数大,空间利用率大,单位体积拥有的Sn原子多,密度大;
(6)灰锡晶胞中Sn原子的个数是8,与金刚石晶胞中C原子个数相同,所以灰锡的密度=m/V=8×119/NA/(a×10-10)3=952/NA(a×10—10)3g/cm3
考点:考查原子结构、物质结构的判断,杂化轨道的判断,晶胞的计算

 鹰派教辅衔接教材河北教育出版社系列答案
鹰派教辅衔接教材河北教育出版社系列答案 初中暑期衔接系列答案
初中暑期衔接系列答案(15分)下表中列出五种短周期元素X、Y、Z、W、T的信息。
| 元素 | 相关信息 |
| X | 基态原子最外层电子排布为nsnnpn+1 |
| Y | 其原子L层电子数是K层3倍 |
| Z | 其单质能与冷水剧烈反应,生成的阴阳离子电子数相同 |
| W | 其单质在Y2中燃烧,发出明亮的蓝紫色火焰 |
| T | 其最高正价与最低负价的代数和为6 |
回答下列问题:
(1)Y、Z、W三种元素所形成的简单离子半径由小到大的顺序是 (用离子符号表示);T元素的基态原子核外电子排布式为 。
(2)X、Z两元素可形成化合物ZX3,其晶体中化学键类型有 ,晶体类型为 。
(3)T元素的最高价氧化物对应水化物的化学式是 H2Y的沸点比H2W高的原因是 。
(4) Z2 WY3溶液呈 性,其原因是(用离子方程式表示) 。
(5)已知25℃、101 kPa下:
①2Z(s)+
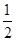 Y2(s)=Z2Y(s) △H1=-414KJ/mol
Y2(s)=Z2Y(s) △H1=-414KJ/mol②2Z(s)+ Y2(s)=Z2Y2(s) △H1=-511KJ/mol
则1mol Z2 Y2(S)与足量Z(s)反应生成Z2 Y(s)的热化学方程式为 。
(13分)短周期元素Q、R、T、W在元素周期表中的位置如右图所示,其中T所处的周期序数与主族序数相等,请回答下列问题: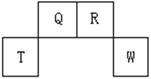
(1)W在周期表中的位置是 , Q、R、T三种元素原子的半径从大到小排列顺序 (用元素符号表示),Q的最高价氧化物的电子式 ,R气态氢化物分子的结构式为 ;
(2)元素的原子得电子能力:Q W(填“强于”或“弱于”);
(3)原子序数比R多8的元素形成的一种常见气态氢化物的沸点 (填“高”或“低”)于R的的常见气态氢化物;
(4)T、Q、R、W的单质中,固态时属于原子晶体的是 (填名称);
(5)现有8种元素的性质、数据如下表所列,它们属于短周期:请指出R元素在下表中的对应编号 ,与T同周期且最高价氧化物的水化物碱性最强的元素在下表中的对应编号 。
| | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
| 原子半径(10-10m) | 0.74 | 1.60 | 1.52 | 1.10 | 0.99 | 1.6 | 0.75 | 0.82 |
| 最高或最低化合价 | | +2 | +1 | +5 | +7 | +1 | +5 | +3 |
| -2 | | | -3 | -1 | | -3 | |


 (3)1 mol AB-中含有的π键个数为________。
(3)1 mol AB-中含有的π键个数为________。