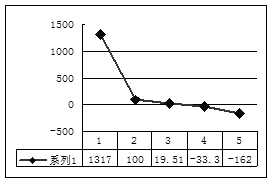
题目内容
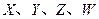 是周期表中原子序数依次增大的前20号元素。
是周期表中原子序数依次增大的前20号元素。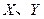 同周期。
同周期。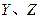 同主族,
同主族,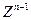 与
与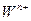 离子的电子层结构相同。由这四种元素形成的单质、化合物有如下图转化关系。已知:常温下
离子的电子层结构相同。由这四种元素形成的单质、化合物有如下图转化关系。已知:常温下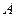 为液体,
为液体,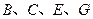 为气态化合物,且
为气态化合物,且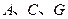 均为直线型分子;
均为直线型分子;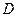 是由元素
是由元素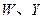 形成的常见化合物。
形成的常见化合物。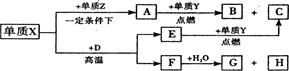
(1)元素W的名称 ,Z的原子结构示意图 ,A的电子式 。
(2)写出D、E的化学式:D 、E 。
(3)①已知38gA与Y完全反应生成B、C时放出口aKJ的热量,写出该反应的热化学
方程式:
②F与水反应的化学方程式:
(1)钙

(2)
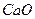
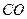 (每空2分,共4分)
(每空2分,共4分)(3)①
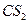
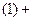

 (3分)
(3分)②
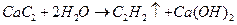
本题考查无机推断。从框图看出,单质Y支持燃烧,猜想为氧气,Y为氧元素,则Z为硫元素,硫与单质X形成的化合物A是液体,且为直线型分子,所以为CS2,X是碳元素,CS2与O2反应方程式为:CS2+3O2=CO2+2SO2,C是直线型分子,所以C是CO2,B为SO2,E在氧气中燃烧得到CO2,又因为E是气体,所以E是CO,Zn-1与Wn+离子的电子层结构相同,所以Wn+为Ca2+,W为Ca元素,则D为CaO,与单质碳的反应为:CaO+3C=CaC2+CO,F是CaC2,CaC2与水反应生成Ca(OH)2和C2H2,G是直线型分子,为C2H2,符合题意。

练习册系列答案
相关题目