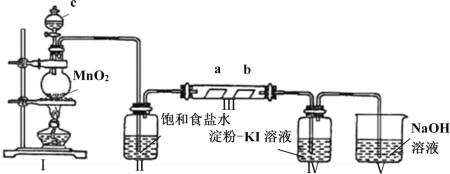
题目内容
【题目】MgO,MgSO4和MgHPO4组成的混合物中镁元素的质量分数为33%,则混合物中氧元素的质量分数为( )
A.16%B.32%C.49%D.55%
【答案】C
【解析】
MgHPO4中H和P的相对原子质量之和为1+31=32和硫的相对原子质量是相等的,因此MgHPO4可以看成是MgSO4,MgSO4可以看成是MgOSO3,所以MgO,MgSO4,和MgHPO4组成的混合物实际可以看成是由氧化镁和三氧化硫组成,据此原子质量守恒进行计算分析。
混合物中氧化镁的质量分数为x,含硫元素的质量分数为y;
根据镁原子质量守恒可得:
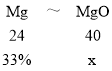
x=55%,则三氧化硫的质量分数为1-55%=45%;
根据硫原子守恒可得:
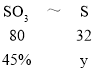
解得y=18%,则混合物中氧元素的质量分数=1-18%-33%=49%,答案选C。

练习册系列答案
 三新快车金牌周周练系列答案
三新快车金牌周周练系列答案
相关题目