题目内容
【题目】(1) TiO2是一种性能优良的半导体光催化剂,能有效地吸附有机污染物,Ti基态核外电子排布式为________________。
(2)甲醛HCHO分子空间构型为_____;分子中碳原子轨道杂化类型为_____,π键和σ键的个数之比为____,
(3)SO2易溶于水的原因是___________________________________。
(4)从原子结构角度解释H2SO4酸性强于H3PO4的原因:___________________________。
(5)含CN-的污水毒性极大,用NaClO先把CN-氧化为CNO-,然后在酸性条件下将CNO-氧化为无污染的气体。请写出与CNO-互为等电子体的微粒______(分子或离子,写一种)。
(6)下列物质在通常状况下的熔点由高到低的顺序为__________(填序号)
①CO ②Al2O3③NH3 ④N2⑤Br2
(7)不考虑空间构型,Ti[(CN)4]2-的结构可表示为:_____________________。
(8)向硫酸铜溶液中逐滴加入氨水先产生沉淀,后沉淀溶解为深蓝色溶液,请根据实验现象写出有关反应的离子方程式 (1)____________________________(2)_____________________________。
【答案】1s22s22p63s23p63d24s2(或[Ar]3d24s2) 平面三角形 sp2 1:3 极性SO2分子易溶于极性的水(或SO2与水相似相溶)SO2与水反应生成亚硫酸,亚硫酸溶于水 H2SO4的非羟基O原子数大于H3PO4的,使S的正电性较大,使H2SO4中-OH的电子向 S偏向程度更大,在水分子作用下更易电离出H+ N2O(CO2、CS2、SCN-等) ②⑤③①④ 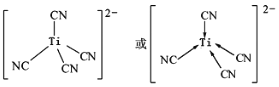 Cu2++2NH3·H2O=Cu(OH)2↓+2NH4+ Cu(OH)2+4NH3·H2O=Cu(NH3)42++4H2O+2OH-
Cu2++2NH3·H2O=Cu(OH)2↓+2NH4+ Cu(OH)2+4NH3·H2O=Cu(NH3)42++4H2O+2OH-
【解析】
(1)Ti为22号元素,按照核外电子排布规律,则基态Ti原子核外电子排布式为1s22s22p63s23p63d24s2(或[Ar]3d24s2);
(2)甲醛中C原子形成3个σ键和1个π键,C上没有孤电子对,C原子的杂化类型为sp2,空间构型为平面三角形,2个C—H键为σ键,碳氧双键中有1个键为σ键,有1个为π键,则π键和σ键的个数之比为1:3;
(3)根据物质相似相溶的原理,极性分子SO2易溶于极性溶剂H2O;此外SO2会与水反应生成亚硫酸,亚硫酸也易溶于水,答案为极性SO2分子易溶于极性的水(或SO2与水相似相溶);SO2与水反应生成亚硫酸,亚硫酸溶于水
(4)硫酸和磷酸的结构简式如图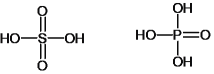 ,可知H2SO4的非羟基O原子数大于H3PO4的,使S的正电性较大,使H2SO4中-OH的电子向 S偏向程度更大,在水分子作用下更易电离出H+;
,可知H2SO4的非羟基O原子数大于H3PO4的,使S的正电性较大,使H2SO4中-OH的电子向 S偏向程度更大,在水分子作用下更易电离出H+;
(5)等电子体是指原子总数和价电子总数均相同的分子、离子和原子团。CNO-的等电子体,C加上一个电子,等于N的电子数,则等电子体中可能为N2O。N加上一个电子,与O的电子数相等,所以还可能为CO2,O和硫同主族,所以还可以为CS2、SCN-等;
(6) Al2O3离子化合物,熔点高;NH3虽相对分子质量只有17,但是分子间存在氢键使得熔点升高;Br2常温下为液体;CO和N2相对分子质量为28, N2为非极性分子,CO是极性分子,CO分子间作用力强于N2,CO的熔点更高些。熔点由高到低的排序为②⑤③①④;
(7)Ti2+和CN-中的C原子形成配位键,形成配离子,不考虑空间构型,结构为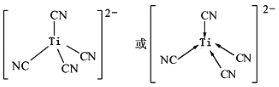 ;
;
(8)首先生成氢氧化铜沉淀,再生成四氨合铜离子,方程式为Cu2++2NH3·H2O=Cu(OH)2↓+2NH4+,Cu(OH)2+4NH3·H2O=Cu(NH3)42++4H2O+2OH-。

 应用题点拨系列答案
应用题点拨系列答案 状元及第系列答案
状元及第系列答案 同步奥数系列答案
同步奥数系列答案【题目】下表是元素周期表的一部分,表中所列的字母分别代表一种化学元素。试回答下列问题:

(1)写出24号元素Cr的基态原子的电子排布式____________。
(2)元素e的基态原子的电子排布图:_______________。
(3)c有_____种运动不同的电子
(4)比较g、h、i三种元素的第一电离能的大小顺序:_______________(按由大到小的顺序排列,用元素符号表示)。
(5)图中o、p两元素的部分电离能数据列于下表:
元素 | o | p | |
电离能/(kJ·mol-1) | I1 | 717 | 759 |
I2 | 1 509 | 1 561 | |
I3 | 3 248 | 2 957 | |
比较两元素的I2、I3可知,气态o2+再失去一个电子比气态p2+再失去一个电子难。对此,你的解释是___________。
(6)第3周期主族元素按单质熔点高低的顺序如图所示,横坐标序号“8”代表______(填元素符号,下同)其中电负性最大的是____。

【题目】HClO4、H2SO4、HNO3和HCl都是强酸,它们的酸性在水溶液中差别不大。以下是某温度下这四种酸在冰醋酸中的电离常数:
酸 | HClO4 | H2SO4 | HCl | HNO3 |
Ka | 1.6×10-5 | 6.3×10-9 | 1.6×10-9 | 4.2×10-10 |
下列说法中不正确的是( )
A.在冰醋酸中这四种酸都没有完全电离
B.在冰醋酸中HClO4是这四种酸中最强的酸
C.在冰醋酸中H2SO4的电离方程式为H2SO4===2H++SO![]()
D.水不能区分这四种酸的强弱,但冰醋酸可以区分这四种酸的强弱