��Ŀ����
����Ŀ����ͼ������A��M��һ�������µ�ת����ϵ�����ֲ��P��Ӧ����δ�г��������У�I���ɵ�������Ԫ����ɵĵ������۵���ߵĽ�����K��һ�ֺ���ɫ���壮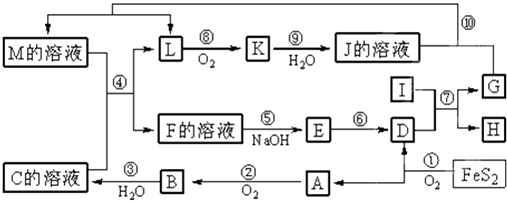
����д���пհף�
��1�������ڱ��У���ɵ���G��Ԫ��λ�ڵ������壮
��2���ڷ�Ӧ�����������뻹ԭ�������ʵ���֮��Ϊ ��
��3���ڷ�Ӧ�ڡ��ۡ��ޡ����У������ڻ��Ϸ�Ӧ�����ڷ�������ԭ��Ӧ���� �� ����д��ţ�
��4����Ӧ�ܵ����ӷ���ʽ�ǣ� ��
��5����������D��KNO3��KOH���ڣ����Ƶ�һ�֡���ɫ��������Ч��ˮ��K2FeO4��������أ���ͬʱ������KNO2��H2O���÷�Ӧ�Ļ�ѧ����ʽ�ǣ� ��
���𰸡�
��1���ģ���
��2��1��2
��3����
��4��3Fe2++4H++NO3��=3Fe3++NO��+2H2O
��5��Fe2O3+3KNO3+4KOH=2K2FeO4+3KNO2+2H2O
���������⣺FeS2�����õ���A���Լ�������������AΪSO2 �� BΪSO3 �� CΪB��ˮ���CΪH2SO4 �� DΪFe2O3 �� IΪ���������۵���ߵĽ�����ӦΪAl����Ӧ��Ϊ��������������������������û���Ӧ�������ȷ�Ӧ��K��һ�ֺ���ɫ���壬ΪNO2 �� ��JΪHNO3 �� L��������ΪNO2 �� ��L����Ϊ����NO2 �� ����C��Һ����������Һ����ijM��Һ��Ӧ�õ�L����L�������Ǽ��Ե����就������LΪNO��G�������ᷴӦ���ܲ���NO����GΪFe��HΪAl2O3 �� �ɷ�Ӧ4FeS2+11O2 ![]() 2Fe2O3+8SO2 �� �����õ���A���Լ�������������AΪSO2 �� BΪSO3 �� CΪB��ˮ���CΪH2SO4 �� DΪFe2O3 �� ��K��һ�ֺ���ɫ���壬KΪNO2 �� JΪHNO3 �� IΪ���������۵���ߵĽ�����ӦΪAl����Ӧ��Ϊ��������������������������û���Ӧ��G�������ᷴӦ���ܲ���NO����GΪFe��HΪAl2O3 �� LΪNO��MӦΪFe��NO3��3��Fe��NO3��2����ϵ��Ӧ�ܣ�M+H2SO4 ��F+NO��֪��MΪFe��NO3��2 �� ��Ӧ���������ʣ�࣬FΪFe��NO3��3��Fe2��SO4��3 �� EӦΪFe��OH��3 �� ��1�������Ϸ�����֪GΪFe����26��Ԫ�أ�λ�����ڱ��������ڵڢ��壬���Դ��ǣ��ģ�������2����Ӧ��ΪAl��Fe2O3���������û���Ӧ������ʽΪ2Al+Fe2O3
2Fe2O3+8SO2 �� �����õ���A���Լ�������������AΪSO2 �� BΪSO3 �� CΪB��ˮ���CΪH2SO4 �� DΪFe2O3 �� ��K��һ�ֺ���ɫ���壬KΪNO2 �� JΪHNO3 �� IΪ���������۵���ߵĽ�����ӦΪAl����Ӧ��Ϊ��������������������������û���Ӧ��G�������ᷴӦ���ܲ���NO����GΪFe��HΪAl2O3 �� LΪNO��MӦΪFe��NO3��3��Fe��NO3��2����ϵ��Ӧ�ܣ�M+H2SO4 ��F+NO��֪��MΪFe��NO3��2 �� ��Ӧ���������ʣ�࣬FΪFe��NO3��3��Fe2��SO4��3 �� EӦΪFe��OH��3 �� ��1�������Ϸ�����֪GΪFe����26��Ԫ�أ�λ�����ڱ��������ڵڢ��壬���Դ��ǣ��ģ�������2����Ӧ��ΪAl��Fe2O3���������û���Ӧ������ʽΪ2Al+Fe2O3 ![]() 2Fe+Al2O3 �� �������������������ǻ�ԭ�����������뻹ԭ�������ʵ���֮��Ϊ1��2�����Դ��ǣ�1��2����3���ڷ�Ӧ�ڡ��ۡ��ޡ����У��ڡ��ޡ��ᶼΪ������ԭ��Ӧ����ΪSO3+H2O=H2SO4�ķ�Ӧ�������ڻ��Ϸ�Ӧ�����ڷ�������ԭ��Ӧ�����Դ��ǣ��ۣ���4��M�к���Fe2+��NO3�� �� �����������¿ɷ���������ԭ��Ӧ����Ӧ�����ӷ���ʽΪ3Fe2++4H++NO3��=3Fe3++NO��+2H2O�����Դ��ǣ�3Fe2++4H++NO3��=3Fe3++NO��+2H2O����5��������Fe2O3��KNO3��KOH���ڣ����Ƶ�һ�֡���ɫ��������Ч��ˮ��K2FeO4��������أ���ͬʱ������KNO2��H2O����Ӧ����ʽΪFe2O3+3KNO3+4KOH=2K2FeO4+3KNO2+2H2O�����Դ��ǣ�Fe2O3+3KNO3+4KOH=2K2FeO4+3KNO2+2H2O��
2Fe+Al2O3 �� �������������������ǻ�ԭ�����������뻹ԭ�������ʵ���֮��Ϊ1��2�����Դ��ǣ�1��2����3���ڷ�Ӧ�ڡ��ۡ��ޡ����У��ڡ��ޡ��ᶼΪ������ԭ��Ӧ����ΪSO3+H2O=H2SO4�ķ�Ӧ�������ڻ��Ϸ�Ӧ�����ڷ�������ԭ��Ӧ�����Դ��ǣ��ۣ���4��M�к���Fe2+��NO3�� �� �����������¿ɷ���������ԭ��Ӧ����Ӧ�����ӷ���ʽΪ3Fe2++4H++NO3��=3Fe3++NO��+2H2O�����Դ��ǣ�3Fe2++4H++NO3��=3Fe3++NO��+2H2O����5��������Fe2O3��KNO3��KOH���ڣ����Ƶ�һ�֡���ɫ��������Ч��ˮ��K2FeO4��������أ���ͬʱ������KNO2��H2O����Ӧ����ʽΪFe2O3+3KNO3+4KOH=2K2FeO4+3KNO2+2H2O�����Դ��ǣ�Fe2O3+3KNO3+4KOH=2K2FeO4+3KNO2+2H2O��

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�