题目内容
W、X、Y、Z是元素周期表中原子前四周期的四种元素,有关它们的信息如下表所示。
元素 | 相关信息 |
W | W的基态原子L层电子数是K层电子数的3倍 |
X | X与氢元素形成的一种化合物可以使湿润的红色石蕊试纸变蓝 |
Y | 单质为黄绿色气体,最高价氧化物对应的水化物化学式为HYO4 |
Z | Z的基态原子外围电子排布式为(n-1)d10ns1 |
(1)Y位于元素周期表第________周期第________族;X的基态原子核外电子排布式是??????????? 。
(2)W的简单离子半径???? X的简单离子半径(填“>”、“<”或“=”);Y的第一电离能比Z的???? (填“大”或“小”);W、X的最简单气态氢化物中,沸点较高的是??????? (填化学式)。
(3)在150℃左右时,化合物ZW与氢气反应生成红色的Z2W粉末,该反应的化学方程式为??????? 。
(4)W元素形成的多种化合物分子中,含有极性共价键和非极性共价键的分子名称为
???????????????????????? (任写一种)。
(5)在25℃、101 kPa下,已知Z固体单质在Y2气体中完全燃烧后恢复至原状态,平均每转移1mol 电子放热110.05kJ,该反应的热化学方程式是?????? ? ???? ???????????????????????????????? 。
(1)三? ⅦA (2分) ? 1s22s22p3????????????? (2分)
(2)< (1分)???? 大(1分)????? H2O (2分)
(3)2CuO + H2 Cu2O + H2O? (2分)??
Cu2O + H2O? (2分)??
(4)过氧化氢(双氧水)(2分)
(5)Cu(s) +Cl2(g)=CuCl2(s)? △H=-220.10kJ/mol(3分)
【解析】
试题分析:W的基态原子L层电子数是K层电子数的3倍,则W为O元素;X与氢元素形成的一种化合物可以使湿润的红色石蕊试纸变蓝,则X为N元素;Y的单质为黄绿色气体,最高价氧化物对应的水化物化学式为HYO4,则Y为Cl元素;Z的基态原子外围电子排布式为(n-1)d10ns1,因为这四种元素位于元素周期表的前四周期,所以Z为CuO。
(1)Y为Cl元素,位于元素周期表第三周期、ⅦA族;X为N元素,其基态原子核外电子排布式为:1s22s22p3
(2)O2?与N3?电子排布相同,原子序数越大,离子半径越小,所以O2?半径<N3?半径;Y为Cl元素,为活泼非金属元素,Z为Cu元素,为金属元素,所以Cl的第一电离能大于Cu的第一电离能;W、X的最简单气态氢化物分别为H2O和NH3,常温下,H2O是液体而NH3是气体,所以H2O的沸点高。
(3)在150℃左右时,化合物ZW与氢气反应生成红色的Z2W粉末,H2把CuO还原为Cu2O,化学方程式为:2CuO + H2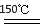 Cu2O + H2O
Cu2O + H2O
(4)氧元素形成的化合物中,含有极性共价键和非极性共价键的分子,最常见的为过氧化氢。
(5)首先写出化学方程式并注明物质的状态,每转移1mol 电子放热110.05kJ,则1molCu完全反应放热-220.10kJ,进而写出热化学方程式为:Cu(s) +Cl2(g)=CuCl2(s)? △H=-220.10kJ/mol
考点:本题考查元素的推断、元素周期律和元素周期表、化学方程式和热化学方程式的书写。

 名校课堂系列答案
名校课堂系列答案 如图为元素周期表前四周期的一部分,W、X、Y、Z是元素周期表中前四周期元素,它们在周期表中的相对位置如表中所示.下列有关叙述中正确的是( )
如图为元素周期表前四周期的一部分,W、X、Y、Z是元素周期表中前四周期元素,它们在周期表中的相对位置如表中所示.下列有关叙述中正确的是( )| A、Z元素一定是金属元素 | B、X、Y、W一定是主族元素 | C、W的氢化物的沸点一定比X的氢化物的沸点高 | D、Z既可能在三周期,也可能在四周期 |
