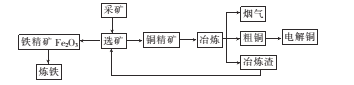
题目内容
【题目】已知![]() 和
和![]() 可以相互转化
可以相互转化![]()
![]() 。现将一定量
。现将一定量![]() 和
和![]() 的混合气体通入体积为1L的恒温恒容的密闭容器中,反应物浓度随时间变化关系如图。下列说法不正确的是
的混合气体通入体积为1L的恒温恒容的密闭容器中,反应物浓度随时间变化关系如图。下列说法不正确的是
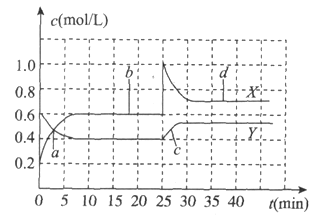
A. 反应进行至25min时,曲线发生变化的原因是加入0.4mol![]()
B. a、b、c、d四个点中,表示化学反应处于平衡状态的点是b和d
C. 图中共有两条曲线X和Y,其中曲线X表示![]() 浓度随时间的变化
浓度随时间的变化
D. 若要达到与d相同的状态,在25min时还可以采取的措施是适当缩小容器体积
【答案】A
【解析】
A.由曲线看出25min时,NO2的浓度突然增大了0.4mol/L,则应加入了0.4mol NO2,故A说法错误;
B.由图可知,10-25min及35min之后X、Y的物质的量不发生变化,则相应时间段内的点处于化学平衡状态,即b和d处于化学平衡状态,故B说法正确;
C.由图可知,X的变化量为Y的2倍,由反应方程式的系数可得X为NO2浓度随时间的变化曲线;故C说法正确;
D.因在25min时,恒温恒容条件下增大NO2的浓度,相当于增大了压强,平衡右移,要使25min时改变条件达到使NO2(g)的百分含量与d点相同的化学平衡状态,也可通过缩上容器的体积来实现,故D说法正确;
答案选A。

【题目】氯苯在染料、医药工业中用于制造苯酚、硝基氯苯、苯胺、硝基酚等有机中间体。实验室中制备氯苯的装置如下图所示(其中夹持仪器及加热装置略去)。
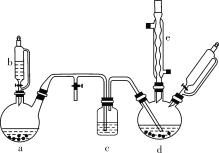
请回答下列问题:
(1)仪器b的名称是___。仪器a中盛有KMnO4晶体,仪器b盛有浓盐酸。打开仪器b的活塞,使浓盐酸缓缓滴下,可观察到仪器a内的现象是____,用离子方程式表示产生该现象的原因:_____
(2)仪器d内盛有苯、FeCl3粉末固体,仪器a中生成的气体经过仪器c进入仪器d中。仪器d中的反应进行过程中,保持温度在40~60 ℃,以减少副反应发生。仪器d的加热方式最好是_____加热,其优点是________________。
(3)该方法制备的氯苯中含有很多杂质,工业生产中,通过水洗除去FeCl3、HCl及部分Cl2,然后通过碱洗除去Cl2。碱洗后通过分液得到含氯苯的有机混合物,混合物成分及沸点如下表所示:
有机物 | 苯 | 氯苯 | 邻二氯苯 | 间二氯苯 | 对二氯苯 |
沸点/℃ | 80 | 132.2 | 180.4 | 173.0 | 174.1 |
从该有机混合物中提取氯苯时,采用蒸馏的方法,收集____℃左右的馏分。