��Ŀ����
����Ŀ��Һ��ʯ��������Ҫ�ɷ�Ϊ���飬��ȼ��ʱ�ܷų��������ȣ���Ϊ��ԴӦ�������ǵ��ճ����������
��֪����C3H8��g��+5O2��g��![]() 3CO2��g��+4H2O��l����H1=-2219.9kJ/mol
3CO2��g��+4H2O��l����H1=-2219.9kJ/mol
��2COg��+O2��g���T2CO2��g����H2=-566kJ/mol
(l)��Ӧ2C3H8��g��+7O2��g���T6CO��g��+8H2O��l���ġ�H=______��
(2)C3H8�ڲ�������������ȼ�գ�����CO����̬ˮ��������Ϊԭ���Ʊ��״��Ĺ�ҵ�������£�
![]()
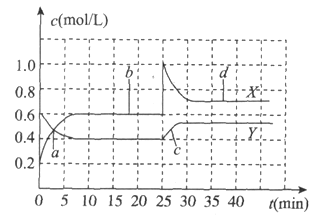
��Ӧ��1Ϊһ���ݻ�Ϊ10 L���ܱ���������850�淢�����·�Ӧ��CO��g��+H2O��g��CO2��g��+H2��g����CO(g)��H2O(g)Ũ���淴Ӧʱ��ı仯����ͼ��ʾ��

0��4 min��ƽ����Ӧ����v(CO2)= ___���÷�Ӧ��850��ʱ�Ļ�ѧƽ�ⳣ��K= ___.
(3)��ѹ�£�0.2 mol CO2��0.6 mol H2�ڴ����������ڷ�Ӧ��2���������ݻ��ɱ䣩�з�����Ӧ���ɼ״���CO2��g��+3H2��g��![]() CH3OH(g)+H2O(g) ��H ,CO2��ƽ��ת�������¶ȡ�ѹǿ�Ĺ�ϵ��ͼ��ʾ��
CH3OH(g)+H2O(g) ��H ,CO2��ƽ��ת�������¶ȡ�ѹǿ�Ĺ�ϵ��ͼ��ʾ��

�ٸ÷�Ӧ�ġ�H __ 0���<����>������
��ѹǿP1 __ p2���<����>������
����P1��100�������£���Ӧ�ﵽƽ������������м���0.1 mol CO2��0.3 mol H2����Ӧ���´ﵽƽ��ʱ��CO2��ƽ��ת����____50%���<����>����=������CH3OH ��ƽ���������____����������䡱��С������
�ܽ�a���ƽ������ͨ��1 L 0��15 mol/LNaOH��Һ�У�������պ�������Һ�е����ʳ��״��⣬����____��������Һ�и����ӵ����ʵ���Ũ���ɴ�С��˳��Ϊ________
���𰸡�-2741.8 kJ/mol 0.03mol/(Lmin) 1 < < = ���� ̼���ƺ�̼������ c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+)
��������
(l)���ݸ�˹���ɽ��м��㣻
��2������ͼ������0��4 min��ƽ����Ӧ����v(CO)����������֮�Ⱥ�ϵ�������ȣ������v(CO2)����������ʽ����ƽ�ⳣ���ļ�����
(3)��ѹǿ���䣬�¶����ߣ�������̼ת���ʼ�С��ƽ�������ȷ�Ӧ�����ƶ���
���¶Ȳ��䣬����ѹǿ��ƽ�����ƣ�������̼ת��������
��ͬ�������ӷ�Ӧ����ں��º�ѹ������ƽ�ⲻ�����ݴ˹��ɽ����жϣ�
�ܸ���CO2ת����50%�������ʣ��Ķ�����̼���������ݶ�����̼��NaOH��Һ������̼���ƺ�̼�����ƹ��ɣ�����ԭ���غ����̼���ƺ�̼�����Ƶ�����ͬŨ�ȵ�̼���ƺ�̼��������Һ��̼����ˮ����������̼�����ƣ��ݴ��жϻ��Һ������Ũ�ȴ�С��ϵ��
(l)��C3H8��g��+5O2��g��![]() 3CO2��g��+4H2O��l����H1=-2219.9kJ/mol
3CO2��g��+4H2O��l����H1=-2219.9kJ/mol
��2COg��+O2��g���T2CO2��g����H2=-566kJ/mol�����ݸ�˹���ɣ�����2-3���ڣ�2C3H8��g��+7O2��g���T6CO��g��+8H2O ��l�� �ġ�H=-2219.9��2+3��566=-2741.8 kJ/mol������������������ǣ�-2741.8 kJ/mol��
(2)0��4 min��ƽ����Ӧ����v(CO2)= v(CO)=��0.20-0.08��/4 mol/(Lmin)=0.03mol/(Lmin)����һ���Ϊ10L�������У�ͨ��һ������CO��H2O��850��ʱ�������·�Ӧ��
CO��g��+ H2O��g�� CO2��g��+ H2����g��
��ʼ����mol/L�� 0.2 0.3 0 0
�仯����mol/L�� 0.12 0.12 0.12 0.12
ƽ������mol/L�� 0.08 0.18 0.12 0.12
ƽ�ⳣ��K=0.12��0.12/0.08��0.18=1��
�������������������0.03mol/(Lmin)��1��
(3)��ѹǿ���䣬�¶����ߣ�������̼ת���ʼ�С��ƽ�������ȷ�Ӧ�����ƶ����÷�Ӧ�ġ�H<0������������������ǣ�<��
���¶Ȳ��䣬����ѹǿ��ƽ�����ƣ�������̼ת��������ѹǿP1 < P2������������������ǣ�<��
����P1��100�������£���Ӧ�ﵽƽ������������м���0.1 mol CO2��0.3 mol H2����ԭƽ��ͬ�������ӷ�Ӧ����ں��º�ѹ����ԭƽ���Ч������ƽ�ⲻ�ƶ�����Ӧ���´ﵽƽ��ʱ��CO2��ƽ��ת���ʵ���50%��CH3OH ��ƽ������������䣻����������������ǣ�=�����䣻
��CO2��g��+3H2��g��![]() CH3OH(g)+H2O(g)��Ӧ��CO2ת����50%����Ӧ��ʣ�������̼����0.2-0.5��0.2=0.1mol��ʣ����������Ϊ0.6-0.5��0.2��3=0.3mol��0.1mol������̼��1 L 0��15 mol/LNaOH��Һ������̼���ƺ�̼�����ƣ���̼������xmol��̼��������ymol����2x+y=0.15��x+y=0.1��x=0.05mol��y=0.05mol�����������Һ�е����ʳ��״��⣬����̼���ƺ�̼�����ƣ��ɴ˿�֪̼���ƺ�̼��������Һ��Ũ����ȣ�ͬŨ�ȵ�������Һ��̼�������ˮ����������̼���������ˮ������������������Һ�и����ӵ����ʵ���Ũ���ɴ�С��˳��Ϊ��c(Na+)> c(HCO3-)>c(CO32-)> c(OH-)> c(H+)������������������ǣ�̼���ƺ�̼�����ƣ�c(Na+)> c(HCO3-)>c(CO32-)> c(OH-)> c(H+)��
CH3OH(g)+H2O(g)��Ӧ��CO2ת����50%����Ӧ��ʣ�������̼����0.2-0.5��0.2=0.1mol��ʣ����������Ϊ0.6-0.5��0.2��3=0.3mol��0.1mol������̼��1 L 0��15 mol/LNaOH��Һ������̼���ƺ�̼�����ƣ���̼������xmol��̼��������ymol����2x+y=0.15��x+y=0.1��x=0.05mol��y=0.05mol�����������Һ�е����ʳ��״��⣬����̼���ƺ�̼�����ƣ��ɴ˿�֪̼���ƺ�̼��������Һ��Ũ����ȣ�ͬŨ�ȵ�������Һ��̼�������ˮ����������̼���������ˮ������������������Һ�и����ӵ����ʵ���Ũ���ɴ�С��˳��Ϊ��c(Na+)> c(HCO3-)>c(CO32-)> c(OH-)> c(H+)������������������ǣ�̼���ƺ�̼�����ƣ�c(Na+)> c(HCO3-)>c(CO32-)> c(OH-)> c(H+)��

 �Ǽ�����������ϵ�д�
�Ǽ�����������ϵ�д� â���̸������Ծ�ϵ�д�
â���̸������Ծ�ϵ�д�