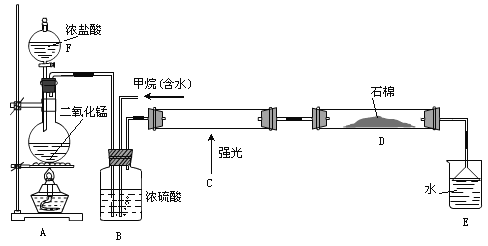
题目内容
【题目】铜的相关化合物在化工、材料等领域有着广泛的应用。回答下列问题:
(1)基态Cu原子中,核外电子占据的最高能层的符号是___________,占据该能层电子的电子_云轮廓图形状为__________;Cu2+价层电子的轨道表达式(电子排布图)为___________。
(2)Cu2O熔点(1235℃)比Cu2S熔点(113℃)高,它们均属于___________晶体,前者熔点较高的原因是_________________________________。
(3)Cu可与N、S,O等元素形成化合物,N、S、O三种元素的第一电离能由大到小的顺序为______________;在Cu的催化作用下,乙醇可被氧化为乙醛,乙醛分子中碳原子的杂化方式是________________。
(4)1mo[Cu(NH3)4]SO4中含有σ键的数目为___________(用NA表示阿伏加德罗常数)。
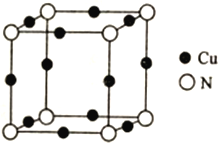
(5)Cu与N所形成的某种晶体的立方晶胞如图所示,其晶胞参数为amm。该晶体的化学式为___________,晶体的密度为___________g·cm-3(列出计算式即可,用NA表示阿伏加德罗常数)。
【答案】N 球形 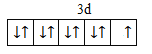 离子 Cu20与Cu2S相比,阳离子相同、阴离子所带的电荷数也相同,但O2-半径比S2-半径小,所以Cu20的晶格能更大,熔点更高 N>O>S sp3 sp2 20NA Cu3N 206×1021/(NA×a3)
离子 Cu20与Cu2S相比,阳离子相同、阴离子所带的电荷数也相同,但O2-半径比S2-半径小,所以Cu20的晶格能更大,熔点更高 N>O>S sp3 sp2 20NA Cu3N 206×1021/(NA×a3)
【解析】
(1) 根据基态Cu原子核外电子排布1s22s22p63s23p63d104s1,判断核外电子占据的最高能层,占据该能层电子的电子云轮廓图形状;画出Cu2+价层电子的轨道表达式;
(2)组成和结构相似的离子晶体,晶格能越大,熔点更高;
(3) 同一主族, 从上到下,第一电离能减小;同周期随原子序数增大,元素第一电离能呈增大趋势,IIA 族、VA族原子第一电离能高于同周期相邻元素;根据价层电子对个数=σ键个数+孤电子对个数,确定甲醛分子中碳原子的杂化方式;
(4)1个NH3中有3个σ键;1个SO42-中含有4个σ键;1个铜原子与4个NH3形成4个配位键;据此进行计算;
(5)利用均摊法计算晶胞中原子个数,从而找出该物质的化学式;先计算1mol晶胞的质量,再根据ρ=m/V求出晶体的密度。
(1) 基态Cu原子核外电子排布: 1s22s22p63s23p63d104s1,核外电子占据的最高能层的符号是N;占据该能层电子的电子云轮廓图形状为球形;Cu2+价层电子的轨道表达式(电子排布图)为,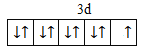 ;综上所述,本题答案是:N;球形;
;综上所述,本题答案是:N;球形; 。
。
(2)Cu20熔点(1235℃)比Cu2S熔点(1130℃)高,其原因是它们都属于离子晶体,但Cu20与Cu2S相比,阳离子相同、阴离子所带的电荷数也相同,但O2-半径比S2-半径小,所以Cu20的晶格能更大,熔点更高;综上所述,本题答案是:离子;Cu20与Cu2S相比,阳离子相同、阴离子所带的电荷数也相同,但O2-半径比S2-半径小,所以Cu20的晶格能更大,熔点更高。
(3) 同一主族, 从上到下,第一电离能减小,同周期随原子序数增大,元素第一电离能呈增大趋势,氮元素原子2p轨道为半满稳定状态,第一电离能高于同周期相邻元素;因此N、S、O三种元素的第一电离能由大到小的顺序为:N>O>S;乙醛中甲基上的C形成4条σ键,无孤电子对,因此采取sp3杂化类型,醛基中的C形成3条σ键和1条π键,无孤电子对,采取sp2杂化类型;
综上所述,本题答案是:N>O>S;sp3 、sp2;
(4)1个[Cu(NH3)4]SO4中,有4个NH3,1个NH3中有3个σ键;共含有4×3=12个σ键;1个SO42-中含有4个σ键;1个铜原子与4个NH3形成4个配位键,即有4个σ键;因此1 moI[Cu(NH3)4]SO4中含有σ键的数目为20NA;综上所述,本题答案是:20NA。
(5)由晶胞图可知,一个晶胞中,Cu原子的数目为12×1/4=3,N原子的数目为8×1/8=1,因此该晶体的化学式为Cu3N;1mol 晶胞的质量为64×3+14=206g,一个晶胞的体积V=(a×10-7)3cm3,因此晶体的密度=206÷[NA×(a×10-7)3]= 206÷[NA×a3×10-21]= 206×1021/(NA×a3) g/cm3;
综上所述,本题答案是:Cu3N;206×1021/(NA×a3)。