题目内容
【题目】根据所学知识完成下面问题:
(1)青蒿素结构如图 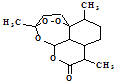 ,有关叙述正确的是(选填序号). a.化学式为C15H21O5 b.不能与NaOH溶液反应
,有关叙述正确的是(选填序号). a.化学式为C15H21O5 b.不能与NaOH溶液反应
c.易溶于水 d.含有过氧键,有较强氧化性
(2)由青蒿酸为原料出发,经五步合成可得到青蒿素.其中第2步为还原反应: 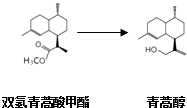 常温下即可反应且略放热,还原剂为LiAlH4 . 相关物质的性质:
常温下即可反应且略放热,还原剂为LiAlH4 . 相关物质的性质:
物质 | 性质 |
双氢青蒿酸甲酯(C16H28O2) | 固体,难溶于水,易溶于有机溶剂. |
青蒿醇(C15H28O) | 固体,难溶于水,易溶于有机溶剂. |
乙醚 | 无色液体,微溶于水;密度0.71g/cm3;沸点:34.6℃. |
氢化铝锂 | 固体,溶于乙醚.与水反应:LiAlH4+4H2O→Al(OH)3↓+LiOH+4H2↑可将一分子酯还原成二分子醇,自身生成醇铝、醇锂.(醇铝、醇锂可与盐酸反应,生成铝盐、锂盐和相应的醇). |
某学习小组在实验室用双氢青蒿酸甲酯制取青蒿醇.
①反应中使用过量的氢化铝锂,理由是 . 为使反应在溶液状态下进行,可用乙醚为溶剂,不用水的理由是 .
②请设计实验室制备装置(画出草图):
(3)该反应有机物的转化率约为96%,所得乙醚溶液中含有醇锂、醇铝、双氢青蒿酸甲酯、氢化铝锂.从反应混合物中提取青蒿醇的方法是:①加后分液;
②从乙醚层提取青蒿醇.有多种方法,以下是二种方案:
方案一:蒸发结晶. 方案二:蒸馏析出晶体.
a.这2个方案在析出晶体后都应有残留液,原因是 .
b.请对这2个方案进行比较 .
【答案】
(1)d
(2)提高双氢青蒿酸甲酯的转化率;双氢青蒿酸甲酯不溶于水,氢化铝锂会与水反应;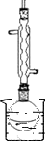
(3)盐酸;防止氢青蒿酸甲酯析出;方案二可回收乙醚、甲醇
【解析】解:(1)a.根据有机物的结构简式判断分子式为C15H22O5 , 故a错误;b.含有酯基,可与氢氧化钠溶液反应,故b错误;c.含有酯基,不溶于水,故c错误;d.由结构简式可知含有过氧键,有较强氧化性,故d正确.所以答案是:d;(2)①还原剂为LiAlH4 , 加入足量还原剂,可提高反应物的转化率;因LiAlH4与水反应,且双氢青蒿酸甲酯不溶于水,不用水作溶剂,所以答案是:提高双氢青蒿酸甲酯的转化率;双氢青蒿酸甲酯不溶于水,氢化铝锂会与水反应;②由题给信息可知装置要点为不加热、密闭且冷凝回流、常温水浴,则装置如图 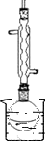 所以答案是:
所以答案是: 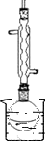 ;(3)①因醇铝、醇锂可与盐酸反应,生成铝盐、锂盐和相应的醇,则可先加入盐酸除去醇锂、醇铝以及氢化铝锂,所以答案是:盐酸;②a.为防止防止氢青蒿酸甲酯析出,可在析出晶体后都应有残留液,所以答案是:防止氢青蒿酸甲酯析出;b.为防止乙醚、甲醇挥发而耗损,可用蒸馏的方法,所以答案是:方案二可回收乙醚、甲醇.
;(3)①因醇铝、醇锂可与盐酸反应,生成铝盐、锂盐和相应的醇,则可先加入盐酸除去醇锂、醇铝以及氢化铝锂,所以答案是:盐酸;②a.为防止防止氢青蒿酸甲酯析出,可在析出晶体后都应有残留液,所以答案是:防止氢青蒿酸甲酯析出;b.为防止乙醚、甲醇挥发而耗损,可用蒸馏的方法,所以答案是:方案二可回收乙醚、甲醇.

【题目】工业上从废铅酸电池的铅膏回收铅的过程中,可用碳酸盐溶液与铅膏(主要成分为PbSO4)发生反应:PbSO4(s)+CO ![]() (aq)PbCO3(s)+SO
(aq)PbCO3(s)+SO ![]() (aq).Ksp (PbCO3)=1.5×10﹣13 , Ksp (PbSO4)=1.8×10﹣8某课题组用PbSO4为原料模拟该过程,探究上述反应的实验条件及固体产物的成分.
(aq).Ksp (PbCO3)=1.5×10﹣13 , Ksp (PbSO4)=1.8×10﹣8某课题组用PbSO4为原料模拟该过程,探究上述反应的实验条件及固体产物的成分.
(1)计算上述反应的平衡常数:K= .
(2)加入足量NaHCO3溶液也可实现该转化,写出离子方程式
(3)查阅文献:上述反应还可能生成碱式碳酸铅[2PbCO3Pb(OH)2],它和PbCO3受热都易分解成PbO.该课题组对固体产物(不考虑PbSO4)的成分提出如下假设,假设一:全部为2PbCO3Pb(OH)2;
假设二:全部为PbCO3;
假设三:2PbCO3Pb(OH)2 和PbCO3的混合物
为验证假设一是否成立,课题组进行如下研究.
实验步骤 | 实验现象和结论 |
取一定量样品充分干燥,然后将样品加热分解,将产生的气体依次通过盛有无水硫酸铜的干燥管和盛有澄清石灰水的洗气瓶. | 无水硫酸铜变蓝色,澄清石灰水变浑浊 |
①你是否同意该同学的结论,并简述理由 .
②如果不同意,请提出改进意见 .