题目内容
【题目】常温下,将pH=3的盐酸和pH=11的氨水等体积混合,完全反应后,溶液中离子浓度关系正确的是( )
A.c(NH ![]() )>c(Cl﹣)>c(OH﹣)>c(H+)
)>c(Cl﹣)>c(OH﹣)>c(H+)
B.c(NH ![]() )>c(Cl﹣)>c(H+)>c(OH﹣)
)>c(Cl﹣)>c(H+)>c(OH﹣)
C.c(Cl﹣)>c(NH ![]() )>c(H+)>c(OH﹣)
)>c(H+)>c(OH﹣)
D.c(Cl﹣)>c(NH ![]() )>c(OH﹣)>c(H+)
)>c(OH﹣)>c(H+)
【答案】A
【解析】解:pH=3的盐酸的物质的量浓度为0.001mol/L,一水合氨为弱电解质,常温下pH=11的氨水中氢氧根离子浓度为0.001mol/L,氨水的浓度一定大于0.001mol/L,
两溶液等体积混合后,氨水过量,溶液呈碱性,则:c(OH﹣)>c(H+),
根据电荷守恒c(NH ![]() )+c(H+)=c(Cl﹣)+c(OH﹣)可知:c(NH
)+c(H+)=c(Cl﹣)+c(OH﹣)可知:c(NH ![]() )>c(Cl﹣),
)>c(Cl﹣),
所以溶液中各离子浓度大小为:c(NH ![]() )>c(Cl﹣)>c(OH﹣)>c(H+),
)>c(Cl﹣)>c(OH﹣)>c(H+),
故选A.

 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案【题目】根据所学知识完成下面问题:
(1)青蒿素结构如图 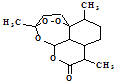 ,有关叙述正确的是(选填序号). a.化学式为C15H21O5 b.不能与NaOH溶液反应
,有关叙述正确的是(选填序号). a.化学式为C15H21O5 b.不能与NaOH溶液反应
c.易溶于水 d.含有过氧键,有较强氧化性
(2)由青蒿酸为原料出发,经五步合成可得到青蒿素.其中第2步为还原反应: 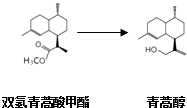 常温下即可反应且略放热,还原剂为LiAlH4 . 相关物质的性质:
常温下即可反应且略放热,还原剂为LiAlH4 . 相关物质的性质:
物质 | 性质 |
双氢青蒿酸甲酯(C16H28O2) | 固体,难溶于水,易溶于有机溶剂. |
青蒿醇(C15H28O) | 固体,难溶于水,易溶于有机溶剂. |
乙醚 | 无色液体,微溶于水;密度0.71g/cm3;沸点:34.6℃. |
氢化铝锂 | 固体,溶于乙醚.与水反应:LiAlH4+4H2O→Al(OH)3↓+LiOH+4H2↑可将一分子酯还原成二分子醇,自身生成醇铝、醇锂.(醇铝、醇锂可与盐酸反应,生成铝盐、锂盐和相应的醇). |
某学习小组在实验室用双氢青蒿酸甲酯制取青蒿醇.
①反应中使用过量的氢化铝锂,理由是 . 为使反应在溶液状态下进行,可用乙醚为溶剂,不用水的理由是 .
②请设计实验室制备装置(画出草图):
(3)该反应有机物的转化率约为96%,所得乙醚溶液中含有醇锂、醇铝、双氢青蒿酸甲酯、氢化铝锂.从反应混合物中提取青蒿醇的方法是:①加后分液;
②从乙醚层提取青蒿醇.有多种方法,以下是二种方案:
方案一:蒸发结晶. 方案二:蒸馏析出晶体.
a.这2个方案在析出晶体后都应有残留液,原因是 .
b.请对这2个方案进行比较 .