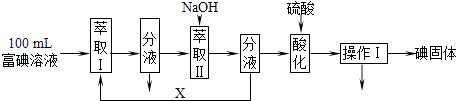
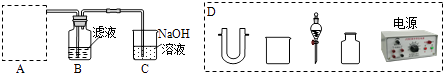��Ŀ����
����Ŀ����ҵ�ϴӷ�Ǧ���ص�Ǧ�����Ǧ�Ĺ����У�����̼������Һ��Ǧ�ࣨ��Ҫ�ɷ�ΪPbSO4��������Ӧ��PbSO4��s��+CO ![]() ��aq��PbCO3��s��+SO
��aq��PbCO3��s��+SO ![]() ��aq����Ksp ��PbCO3��=1.5��10��13 �� Ksp ��PbSO4��=1.8��10��8ij��������PbSO4Ϊԭ��ģ��ù��̣�̽��������Ӧ��ʵ���������������ijɷ֣�
��aq����Ksp ��PbCO3��=1.5��10��13 �� Ksp ��PbSO4��=1.8��10��8ij��������PbSO4Ϊԭ��ģ��ù��̣�̽��������Ӧ��ʵ���������������ijɷ֣�
��1������������Ӧ��ƽ�ⳣ����K= ��
��2����������NaHCO3��ҺҲ��ʵ�ָ�ת����д�����ӷ���ʽ
��3���������ף�������Ӧ���������ɼ�ʽ̼��Ǧ[2PbCO3Pb��OH��2]������PbCO3���ȶ��ֽ��PbO���ÿ�����Թ�����������PbSO4���ijɷ�������¼��裬����һ��ȫ��Ϊ2PbCO3Pb��OH��2��
�������ȫ��ΪPbCO3��
��������2PbCO3Pb��OH��2 ��PbCO3�Ļ����
Ϊ��֤����һ�Ƿ��������������������о���
ʵ�鲽�� | ʵ������ͽ��� |
ȡһ������Ʒ��ָ��Ȼ����Ʒ���ȷֽ⣬����������������ͨ��ʢ����ˮ����ͭ�ĸ���ܺ�ʢ�г���ʯ��ˮ��ϴ��ƿ�� | ��ˮ����ͭ����ɫ������ʯ��ˮ����� |
�����Ƿ�ͬ���ͬѧ�Ľ��ۣ����������� ��
�������ͬ�⣬������Ľ���� ��
���𰸡�
��1��1.2��105
��2��2HCO ![]() +PbSO4=SO
+PbSO4=SO ![]() +PbCO3+H2O+CO2��
+PbCO3+H2O+CO2��
��3����ͬ�⣮��Ϊ����������ͬ����������������ͨ��������Ũ����ͳ���ʯ��ˮ�����ֱ�������ص�������ͨ������ȷ��HԪ�غ�CԪ�ص����ʵ���֮�ȣ���n��C����n��H��=1��1����Ϊ����һ����n��c����n��H����1��1����Ϊ������
���������⣺��1��ƽ�ⳣ��K= ![]() =
= ![]() =
= ![]() =1.2��105 �� ���Դ��ǣ�1.2��105����2��HCO3���ɵ����CO32�� �� ��PbSO4��Ӧ����PbCO3 �� ��Ӧ�����ӷ���ʽΪ2HCO3��+PbSO4=SO42��+PbCO3+H2O+CO2�������Դ��ǣ�2HCO3��+PbSO4=SO42��+PbCO3+H2O+CO2������3���ٽ���Ʒ���ȣ���ˮ����ͭ����ɫ������ʯ��ˮ����ǣ���˵������ˮ�Ͷ�����̼��������˵����Ʒȫ����2PbCO3Pb��OH��2 �� Ҳ����Ϊ2PbCO3Pb��OH��2 ��PbCO3�Ļ�����2PbCO3Pb��OH��2 ��PbCO3�Ļ����ֱ�Ҳ��ʹ��ˮ����ͭ����ɫ������ʯ��ˮ����ǣ����Դ��ǣ���ͬ�⣮��Ϊ����������ͬ����������Ϊ2PbCO3Pb��OH��2 �� ������n��C����n��H��=1��1���ɽ���������ͨ��������Ũ����ͳ���ʯ��ˮ�����ֱ�������ص�������ͨ������ȷ��HԪ�غ�CԪ�ص����ʵ���֮�ȣ���n��C����n��H��=1��1����Ϊ����һ����n��c����n��H����1��1����Ϊ�����������Դ��ǣ�����������ͨ��������Ũ����ͳ���ʯ��ˮ�����ֱ�������ص�������ͨ������ȷ��HԪ�غ�CԪ�ص����ʵ���֮�ȣ���n��C����n��H��=1��1����Ϊ����һ����n��c����n��H����1��1����Ϊ��������
=1.2��105 �� ���Դ��ǣ�1.2��105����2��HCO3���ɵ����CO32�� �� ��PbSO4��Ӧ����PbCO3 �� ��Ӧ�����ӷ���ʽΪ2HCO3��+PbSO4=SO42��+PbCO3+H2O+CO2�������Դ��ǣ�2HCO3��+PbSO4=SO42��+PbCO3+H2O+CO2������3���ٽ���Ʒ���ȣ���ˮ����ͭ����ɫ������ʯ��ˮ����ǣ���˵������ˮ�Ͷ�����̼��������˵����Ʒȫ����2PbCO3Pb��OH��2 �� Ҳ����Ϊ2PbCO3Pb��OH��2 ��PbCO3�Ļ�����2PbCO3Pb��OH��2 ��PbCO3�Ļ����ֱ�Ҳ��ʹ��ˮ����ͭ����ɫ������ʯ��ˮ����ǣ����Դ��ǣ���ͬ�⣮��Ϊ����������ͬ����������Ϊ2PbCO3Pb��OH��2 �� ������n��C����n��H��=1��1���ɽ���������ͨ��������Ũ����ͳ���ʯ��ˮ�����ֱ�������ص�������ͨ������ȷ��HԪ�غ�CԪ�ص����ʵ���֮�ȣ���n��C����n��H��=1��1����Ϊ����һ����n��c����n��H����1��1����Ϊ�����������Դ��ǣ�����������ͨ��������Ũ����ͳ���ʯ��ˮ�����ֱ�������ص�������ͨ������ȷ��HԪ�غ�CԪ�ص����ʵ���֮�ȣ���n��C����n��H��=1��1����Ϊ����һ����n��c����n��H����1��1����Ϊ��������

����Ŀ��������ѧ֪ʶ����������⣺
��1�������ؽṹ��ͼ 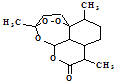 ���й�������ȷ������ѡ����ţ��� a����ѧʽΪC15H21O5 b��������NaOH��Һ��Ӧ
���й�������ȷ������ѡ����ţ��� a����ѧʽΪC15H21O5 b��������NaOH��Һ��Ӧ
c��������ˮ d�����й��������н�ǿ������
��2����������Ϊԭ�ϳ��������岽�ϳɿɵõ������أ����е�2��Ϊ��ԭ��Ӧ�� 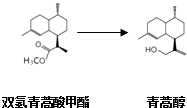 �����¼��ɷ�Ӧ���Է��ȣ���ԭ��ΪLiAlH4 �� ������ʵ����ʣ�
�����¼��ɷ�Ӧ���Է��ȣ���ԭ��ΪLiAlH4 �� ������ʵ����ʣ�
���� | ���� |
˫�������������C16H28O2�� | ���壬������ˮ���������л��ܼ��� |
���ﴼ��C15H28O�� | ���壬������ˮ���������л��ܼ��� |
���� | ��ɫҺ�壬����ˮ���ܶ�0.71g/cm3���е㣺34.6�森 |
�⻯��� | ���壬�������ѣ���ˮ��Ӧ��LiAlH4+4H2O��Al��OH��3��+LiOH+4H2���ɽ�һ��������ԭ�ɶ����Ӵ����������ɴ�������ﮣ�����������﮿������ᷴӦ���������Ρ���κ���Ӧ�Ĵ����� |
ijѧϰС����ʵ������˫�������������ȡ���ﴼ��
�ٷ�Ӧ��ʹ�ù������⻯��ﮣ������� �� Ϊʹ��Ӧ����Һ״̬�½��У���������Ϊ�ܼ�������ˮ�������� ��
�������ʵ�����Ʊ�װ�ã�������ͼ����
��3���÷�Ӧ�л����ת����ԼΪ96%������������Һ�к��д�ﮡ�������˫��������������⻯��ﮣ��ӷ�Ӧ���������ȡ���ﴼ�ķ����ǣ��ټ����Һ��
�ڴ����Ѳ���ȡ���ﴼ���ж��ַ����������Ƕ��ַ�����
����һ�������ᾧ�� �������������������壮
a����2�����������������Ӧ�в���Һ��ԭ���� ��
b�������2���������бȽ� ��