题目内容
(15分)
亚硝酸钠(NaNO2)易溶于水,微溶于乙醚,是常用的食品发色剂
(1)第一电离能:N ___O(填“<”、“>”或“=”);NO2-的空间构型为____
(2)亚硝酸钠在3200C会分解生成氧化钠、一氧化二氮等物质,该反应的化学方程式为____
(3)亚硝酸钠是亚硝酸的钠盐。HNO2的结构如图所示,则HNO2分子中有___个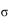 键:
键:
HNO2的酸性比HN03弱是因为_____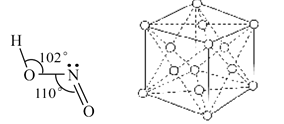
(4)亚硝基钻钠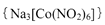 是钴的一种配合物,易溶于水,与钾离子反应生成淡黄色的
是钴的一种配合物,易溶于水,与钾离子反应生成淡黄色的 沉淀,可用于检验K+的存在。
沉淀,可用于检验K+的存在。
①基态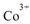 的价层电子排布图为_____
的价层电子排布图为_____
②用亚硝酸钻钠检验K+的离子方程式是
③金属钴的堆积方式如图所示,若一个钴原子的半径为r,,则晶胞的体积V(晶胞)=__
(15分)
(1) > (1分) V型或角型(1分)
(2)2NaNO2 Na2O+N2O↑+O2↑(2分)
Na2O+N2O↑+O2↑(2分)
(3)3(2分)
HNO3中的N的正电性高,导致N—O—H中O的电子向N偏移程度大于HNO3,更容易电离出H+,酸性更强(3分) 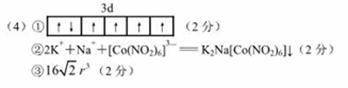
解析试题分析:(1)因为N元素为VA族元素,N原子2p轨道排布3个电子,为半充满状态,为较稳定状态,失去电子较难,所以第一电离能:N > O;NO2-中N价电子为5,所以杂化轨道数=(5+1)÷2=3,所以N原子杂化方式为sp2,所以NO2-的空间构型为V型或角型。
(2)亚硝酸钠在3200C会分解生成氧化钠、一氧化二氮等物质,配平可得化学方程式:2NaNO2 Na2O +N2O↑+O2↑
Na2O +N2O↑+O2↑
(3)单键为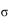 键,双键中的一个键为
键,双键中的一个键为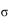 键,根据HNO2的结构简式可知HNO2分子中有3个
键,根据HNO2的结构简式可知HNO2分子中有3个 键;HNO3中的N的正电性高,导致N—O—H中O的电子向N偏移程度大于HNO3,更容易电离出H+,酸性更强。
键;HNO3中的N的正电性高,导致N—O—H中O的电子向N偏移程度大于HNO3,更容易电离出H+,酸性更强。
(4)①Co为27号元素,Co3+的价层电子为3d6,所以基态Co3+的3d轨道有1个排布2个电子,其它4个轨道排布1个电子。
②根据亚硝基钻钠{Na3[Co(NO2)6]}与钾离子反应生成淡黄色的K2Na[Co(NO2)6]沉淀,可得离子方程式为:2K++Na++[Co(NO2)6]3- = K2Na[Co(NO2)6]↓
③根据钴晶体堆积方式可知,其晶胞为面向立方,面对角线等于4r,设晶胞的边长为a,则4r=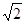 a,可得a=2
a,可得a=2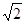 r,则晶胞的体积V(晶胞)=a3=(2
r,则晶胞的体积V(晶胞)=a3=(2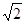 r)3=16
r)3=16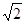 r3。
r3。
考点:本题考查电子排布、杂化类型、空间结构、第一电离能比较、方程式书写、化学键、晶胞计算。

 阅读快车系列答案
阅读快车系列答案不同元素的原子在分子内吸引电子的能力大小可用一定数值x来表示, x越大,其原子吸引电子的能力越强。 下面是某些短周期元素的x值:
| 元素符号 | Li | Be | B | C | O | F | Na | Al | Si | P | S | Cl |
| x值 | 0.98 | 1.57 | 2.04 | 2.55 | 3.44 | 3.98 | 0.93 | 1.61 | 1.90 | 2.19 | 2.58 | 3.16 |
(1)通过分析x值变化规律,确定Mg的x值范围:_______ < x(Mg) <_________。
(2)推测x值与原子半径的关系是________________________________;根据短周期元素的x值变化特点,体现了元素性质的_________________变化规律。
(3)分别指出下列两种化合物中氧元素的化合价:HClO_________,HFO________。
(4)经验规律告诉我们:当成键的两原子相应元素x数值的差值(Δx),当Δx>1.7时,一般为离子键,当Δx<1.7时,一般为共价键,试推断AlBr3中化学键类型是________________。
(5)预测元素周期表中,x值最小的元素位于______周期________族(放射性元素除外)。
(12分)下表为元素周期表的一部分,请参照元素①-⑨在表中的位置,用化学用语回答下列问题:
| 族 周期 | IA | | 0 | |||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | | | | ② | ③ | ④ | | |
| 3 | ⑤ | | ⑥ | | | ⑦ | ⑧ | ⑨ |
元素是 。(均填元素符号)
(2)元素⑦与元素⑧相比,⑧的非金属性较强,下列表述中能证明这一事实的是
a.常温下⑦的单质和⑧的单质状态不同
b.⑧的氢化物比⑦的氢化物稳定
c.一定条件下⑦和⑧的单质都能与氢氧化钠溶液反应
d.⑦的氧化物的水化物比⑧的氧化物的水化物酸性弱
设计一个简单实验,证明元素⑦与元素⑧的非金属性强弱,只写出反应的化学方程式(不写实验步骤)______________________________________
(3)⑤与⑥两元素最高价氧化物的水化物相互反应的离子方程式为 _____________________________________________________
(4)③的氢化物的电子式为__________________
(5)①④⑤三种元素形成的最简单一种化合物含有的化学键类型有
(15分)W、M、N、X、Y、Z是六种常见的短周期元素,其原子半径随原子序数的变化如右图所示,已知W的一种同位素的质量数为18,中子数为10;M和Ne原子的核外电子数相差1;N与X相邻,N的单质是日常生活中常用的金属材料;Y的最外层电子数是其最内层电子数的3倍;Z的非金属性在同周期主族元素中最强。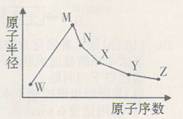
(1)W的另一种同位素的质子数与中子数相等,原子符号表示为 ;元素Y在周期表中的位置是 。
(2)下列有关物质性质的比较中,正确的是 (填字母编号)。
| A.W、X、Y三种元素最简单氢化物的稳定性:W>Y>X |
| B.M、X、Z三种元素形成的单质熔点:X>M>Z |
| C.Y、Z两种元素的含氧酸酸性:Z>Y |
| D.Y、Z两种元素的单核阴离子还原性:Y>Z |
(4)元素X与Z形成的五原子分子的空间结构属于 形。
(5)与Z同族的元素都能与氢元素形成氢化物,其中水溶液酸性最弱的是 (填化学式)。
(6)含有N元素的两种离子在溶液中相遇能快速发生反应,写出该反应的离子方程式 。
下列变化过程中,只破坏共价键的是( )
| A.I2升华 | B.NaCl颗粒被粉碎 |
| C.HCl溶于水得盐酸 | D.从NH4HCO3中闻到了刺激性气味 |
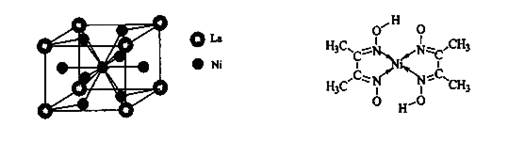
 键,碳氮之间的共价键类型是______________,氮镍之间形成的化学键是_______________;
键,碳氮之间的共价键类型是______________,氮镍之间形成的化学键是_______________;
 X,其氯化物XCl2 1.11 g配成溶液后,需用20 mL 1 mol·L-1的AgNO3溶液才能把氯离子完全沉淀下来。已知X核素中有20个中子。
X,其氯化物XCl2 1.11 g配成溶液后,需用20 mL 1 mol·L-1的AgNO3溶液才能把氯离子完全沉淀下来。已知X核素中有20个中子。