题目内容
4.下列各组性质比较中,不正确的是( )| A. | 还原性 F->Cl->Br- | B. | 碱性:Na(OH)2>Mg(OH)2>Al(OH)3 | ||
| C. | 酸性 HClO4>HBrO4>HIO4 | D. | 稳定性 HCl>H2S>PH3 |
分析 A.元素的非金属性越强,其简单阴离子的还原性越弱;
B.元素的金属性越强,其最高价氧化物的水化物碱性越强;
C.元素的非金属性越强,其最高价氧化物的水化物酸性越强;
D.元素的非金属性越强,其氢化物的稳定性越强.
解答 解:A.元素的非金属性越强,其简单阴离子的还原性越弱,非金属性F>Cl>Br,所以还原性:F-<Cl-<Br-,故A错误;
B.元素的金属性越强,其最高价氧化物的水化物碱性越强,金属性Na>Mg>Al,所以碱性:Na(OH)2>Mg(OH)2>Al(OH)3,故B正确;
C.元素的非金属性越强,其最高价氧化物的水化物酸性越强,非金属性Cl>Br>I,所以酸性 HClO4>HBrO4>HIO4,故C正确;
D.元素的非金属性越强,其氢化物的稳定性越强,非金属性Cl>S>P,所以稳定性:HCl>H2S>PH3,故D正确;
故选A.
点评 本题以元素周期律知识,侧重考查学生分析判断能力,明确金属性、非金属性强弱判断方法是解本题关键,注意非金属性强弱判断与得失电子难易程度有关,与得失电子多少无关,题目难度不大.

练习册系列答案
 能力评价系列答案
能力评价系列答案 唐印文化课时测评系列答案
唐印文化课时测评系列答案
相关题目
14.下列化学实验的处理及现象不正确的是( )
| A. | 鉴别溶液中是否含有SO42- 时,先滴入稀盐酸使溶液酸化,再滴入氯化钡溶液 | |
| B. | 实验室用H2O2分解制O2,加入少量MnO2后,反应速率明显加快 | |
| C. | 为了加快制取NO气体的速度,可用浓硝酸代替稀硝酸与铜反应 | |
| D. | 检验溶液中是否含有NH4+,可加入足量NaOH溶液,加热,再用湿润的红色石蕊试纸伸入试管内检验是否变蓝 |
15.下列化合物不是离子化合物的是( )
| A. | SiO2 | B. | KHCO3 | C. | NH4Br | D. | NaOH |
12.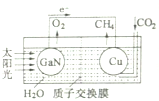 科学家用氮化镓材料与铜组装成如图的人工光合系统,实现了以CO2和H2O为原料合成CH4,下列有关说法中正确的是( )
科学家用氮化镓材料与铜组装成如图的人工光合系统,实现了以CO2和H2O为原料合成CH4,下列有关说法中正确的是( )
 科学家用氮化镓材料与铜组装成如图的人工光合系统,实现了以CO2和H2O为原料合成CH4,下列有关说法中正确的是( )
科学家用氮化镓材料与铜组装成如图的人工光合系统,实现了以CO2和H2O为原料合成CH4,下列有关说法中正确的是( )| A. | 该装置是将化学能转化为电能 | |
| B. | 氮化镓电极是正极 | |
| C. | 铜电极表面的电极反应式为:CO2+8e-+8H+=CH4+2H2O | |
| D. | 可用盐酸作该装置的电解液 |
3.25℃时,向10ml0.01mol/LKOH溶液中滴加0.01mol/L苯酚溶液,混合溶液中粒子浓度关系正确的( )
| A. | pH>7时,c(C6H5O-)>c(K+)>c(H+)>c(OH-) | |
| B. | pH<7时,c(K+)>c(C6H5O-)>c(H+)>c(OH-) | |
| C. | V[C6H5OH(aq)]=20ml时,c(C6H5O-)+c(C6H5OH)=2c(K+) | |
| D. | V[C6H5OH(aq)]=10ml时,c(K+)=c(C6H5O-)>c(OH-)=c(H+) |
10.NA表示阿伏加德罗常数的值,下列说法中正确的是( )
| A. | 常温常压下,21g氧气和27g臭氧所含氧原子总数为3NA | |
| B. | 34gH2O2中含阴离子数为NA | |
| C. | 饱和FeCl3溶液加入沸水中,若有1molFeCl3水解,可生成NA个胶体粒子 | |
| D. | 80mL10mol/L浓盐酸与足量MnO2加热反应,转移电子数为0.4NA |
8.X元素最高价氧化物对应的水化物为HXO3,其气态氢化物为( )
| A. | HX | B. | XH3 | C. | H2X | D. | XH4 |