题目内容
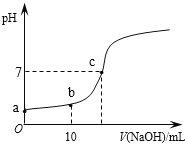
【题目】一定温度下,在2L的密闭容器中,M、N两种气体的物质的量随时间变化的曲线如图所示:
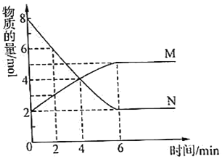
(1)反应的化学方程式为___。
(2)反应达到最大限度的时间是__min,该时间内的平均反应速率υ(N)=__。
(3)反应达到平衡状态时,放出6QkJ的热量。若容器开始时充入lmolN,反应放出的热量为__。
A.等于QkJ B.小于QkJ C.大于QkJ D.等于2QkJ
(4)判断该反应达到平衡状态的依据是___。
①该条件下,正逆反应速率都为零
②该条件下,混合气体的平均摩尔质量不再发生变化
③该条件下,混合气体的压强不再发生变化
④该条件下,单位时间内消耗2mol N的同时,生成1mol M
(5)能加快反应速率的措施是___。
①升高温度 ②容器体积不变,充入惰性气体Ar
③容器压强不变,充入惰性气体Ar ④使用催化剂
(6)一定温度下,将一定量的N2和H2充入2L固定体积的密闭容器中进行反应:N2(g)+3H2(g)![]() 2NH3(g)。若起始时向容器中充入10mol的N2和15mol的H2,10min时达到平衡,测得容器内NH3的浓度为2molL﹣1。10min时N2的转化率为___;平衡时的压强和起始时的压强之比为___。
2NH3(g)。若起始时向容器中充入10mol的N2和15mol的H2,10min时达到平衡,测得容器内NH3的浓度为2molL﹣1。10min时N2的转化率为___;平衡时的压强和起始时的压强之比为___。
【答案】2NM 6 0.5mol/(Lmin) B ②③ ①④ 20% 21:25
【解析】
(1)结合图示信息根据相同时间内各物质的物质的量改变量之比等于其计量数之比,分析反应物与生成物的化学计量数;
(2)反应达到最大限度时,各物质的物质的量及浓度保持不变;根据化学反应速率的公式求解;
(3)根据可逆反应的特点回答问题;
(4)反应到达平衡状态时,正逆反应速率相等,平衡时各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,由此进行判断;
(5)根据影响化学反应速率的因素回答;
(6)列三段式,利用定义求解转化率;同条件下,气体的压强之比等于气体的物质的量之比。
(1)根据图知,反应物是N、生成物是M,相同时间内△n(N)=(8-2)mol=6mol、△n(M)=(5-2)mol=3mol,相同时间内各物质的物质的量改变量之比等于其计量数之比,则N、M的计量数之比为6mol:3mol=2:1,故化学方程式为:2N![]() M;
M;
(2)根据图像可知反应进行到6min时物质的物质的量不再发生变化,因此反应达到最大限度的时间是6min,该时间内的平均反应速率υ(N)= ![]() =0.5 mol/(L·min),故答案为:6;0.5mol/(Lmin);
=0.5 mol/(L·min),故答案为:6;0.5mol/(Lmin);
(3)反应达到平衡状态时,放出6Q kJ的热量,即消耗6mol N放出6Q kJ的热量,由于是可逆反应,则1molN不能完全消耗,所以反应放出的热量为小于QkJ,故答案为B;
(4)①达到平衡状态时正逆反应速率相等,但不能为零,①项错误;
②平均摩尔质量是混合气的质量和混合气的物质的量的比值,在反应过程中质量始终不变,但混合气体的物质的量为变量,则混合气体的平均摩尔质量不再发生变化能说明反应达到平衡状态,②项正确;
③正反应体积减小,则该条件下,混合气体的压强不再发生变化能说明反应达到平衡状态,③项正确;
④该条件下,单位时间内消耗2molN的同时,生成1molM均表示正反应速率,不能说明反应达到平衡状态,④项错误;
故答案为②③;
(5)①升高温度反应速率加快,①符合题意;
②容器体积不变,充入惰性气体Ar,反应物浓度不变,反应速率不变,②项不符合题意;
③容器压强不变,充入惰性气体Ar,容器容积增大,反应物浓度减小,反应速率减小,③项不符合题意;
④使用催化剂反应速率加快,④项符合题意;
答案选①④;
(6)若起始时向容器中充入10mol的N2和15mol的H2,10min时达到平衡,测得容器内NH3的浓度为2molL﹣1,即生成的氨气的物质的量为2molL﹣1![]() 2L=4mol,则有
2L=4mol,则有
N2(g)+3H2(g)![]() 2NH3(g)
2NH3(g)
起始量(mol) 10 15 0
转化量(mol) 2 6 4
平衡量(mol) 8 9 4
则10min时N2的转化率为![]() =20%;
=20%;
同条件下,平衡时的压强和起始时的压强之比等于其物质的量之比,即为![]() =21:25,
=21:25,
故答案为:20%;21:25。

 步步高达标卷系列答案
步步高达标卷系列答案