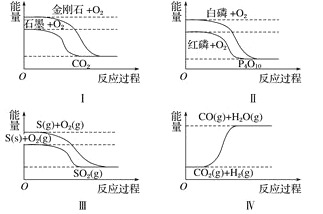
��Ŀ����
����Ŀ�������缫������KOH��Һ�У�Ȼ��ֱ�������ͨ��CH4��O2����������������Ϊ����ȼ�ϵ�ء���֪����ȼ�ϵ�������缫�ϵķ�Ӧ�ֱ�ΪCH4��8e-��10OH-=CO32-��7H2O��2O2��8e-��4H2O=8OH-�������й�˵���д�����ǣ� ��
A.CH4�ڸ����Ϸ�Ӧ��O2�������Ϸ�Ӧ
B.�ŵ�����е������Һ�ļ��Լ���
C.�˵�����ڻ����Ѻ��͵��
D.�˵���л�ѧ��100%ת��Ϊ����
���𰸡�D
��������
A��CH4ȼ�ϵ���У�ȼ��ʧ���ӷ���������Ӧ������CH4�ڸ����Ϸ�Ӧ�������õ��ӷ�����ԭ��Ӧ������O2�������Ϸ�Ӧ����A��ȷ��
B�����ݵ���ܷ�ӦCH4��2O2��2OH��=![]() ��3H2O֪��OH���μӷ�Ӧ��������Һ��OH��Ũ�Ƚ��ͣ���Һ�ļ��Լ�������B��ȷ��
��3H2O֪��OH���μӷ�Ӧ��������Һ��OH��Ũ�Ƚ��ͣ���Һ�ļ��Լ�������B��ȷ��
C���õ�طŵ�ʱ�������Ի�������Ⱦ�����ʣ��������ڻ����Ѻ��͵�أ���C��ȷ��
D���˵���л�ѧ��ת��Ϊ���ܺ��������ܣ���D����
��ѡD��

����Ŀ���״�����Ҫ�Ļ���ԭ�ϣ��ֿɳ�Ϊȼ�ϡ����úϳ�������Ҫ�ɷ�ΪCO��CO2��H2���ڴ����������ºϳɼ״�������������Ӧ���£�
��CO(g)+2H2(g)![]() CH3OH(g) ��H1
CH3OH(g) ��H1
��CO2(g)+3H2(g)![]() CH3OH��g��+H2O(g) ��H2
CH3OH��g��+H2O(g) ��H2
��CO2(g)+H2(g)![]() CO(g)+H2O(g) ��H3
CO(g)+H2O(g) ��H3
�ش��������⣺
��1����֪��Ӧ���е���صĻ�ѧ�������������£�
��ѧ�� | H-H | C-O | C | H-O | C-H |
E/��kJ.mol-1�� | 436 | 343 | 1076 | 465 | 413 |
�ɴ˼�����H1=________kJ.mol-1����֪��H2=-58kJ.mol-1������H3=_________kJ.mol-1
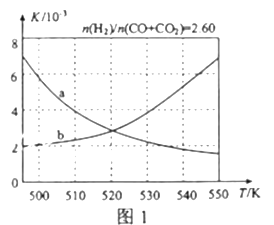
��2����Ӧ�ٵĻ�ѧƽ�ⳣ��K�ı���ʽΪ_____________��ͼ1������ȷ��ӳƽ�ⳣ��K���¶ȱ仯��ϵ������Ϊ______�������߱����ĸ�������ж�������__________________��
 .
.