题目内容
5.设NA表示阿伏加德罗常数的值,下列说法不正确的是( )| A. | 醋酸的摩尔质量与NA个醋酸分子的质量在数值上是相等的 | |
| B. | 22.4L氨气所含的原子数目为4NA,所含的电子数为10NA | |
| C. | 标况下,22.4L任意比的氢气和氯气的混合气体中含有的分子总数均是NA | |
| D. | 2L 0.5mol/L的硫酸钠溶液中的硫酸根的个数是NA |
分析 A、醋酸的摩尔质量为60g/mol,NA个醋酸分子的质量为60g;
B、氨气所处的状态不明确;
C、根据n=$\frac{V}{Vm}$=$\frac{N}{{N}_{A}}$计算;
D、求出硫酸钠的物质的量n=CV,然后根据1mol硫酸钠中含1mol硫酸根来分析.
解答 解:A、醋酸的摩尔质量为60g/mol,NA个醋酸分子的质量为60g,故两者在数值上是相等的,故A正确;
B、氨气所处的状态不明确,不一定是标况,故22.4L氨气的物质的量不一定是1mol,故含有的电子的个数不一定是10NA,故B错误;
C、根据n=$\frac{V}{Vm}$=$\frac{N}{{N}_{A}}$可知,22.4L任意比的氢气和氯气的混合气体的物质的量为1mol,分子数为NA,故C正确;
D、硫酸钠的物质的量n=CV=0.5mol/L×2L=1mol,而1mol硫酸钠中含1mol硫酸根即NA个,故D正确.
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
15.食盐中加有KIO3,KIO3在工业上以石墨和铁为电极,用电解KI溶液方法制取,以下有关说法正确的是( )
| A. | 电解时,石墨作阴极,铁作阳极 | |
| B. | 阴极的电极反应式为:2H++2e-═H2↑ | |
| C. | 电解过程中阳极周围溶液的pH变大 | |
| D. | 理论上每生成1molKIO3则电路中流过6mole- |
16.能大量共存且溶液是无色的离子组合是( )
| A. | H+、Na+、CO32-、MnO4- | B. | Cu2+、K+、NO3-、SO42- | ||
| C. | K+、H+、NO3-、OH- | D. | Mg2+、Ca2+、Cl-、NO3- |
13.如图是电解CuCl2溶液的装置,其中c、d为石墨电极,则下列有关判断正确的是( )
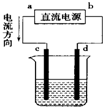

| A. | a为负极,b为正极 | B. | d为阳极,c为阴极 | ||
| C. | 电解过程中,d电极质量增加 | D. | 电解过程中,氯离子浓度不变 |
20.工业合成氨反应是700K左右进行的,这主要原因是( )
| A. | 700K时此反应速率最快 | |
| B. | 700K时氨的平衡浓度最大 | |
| C. | 700K时氨的转化率最高 | |
| D. | 700K该反应的催化剂能发挥最大的作用 |
10.若7x%和x%的两种液体等体积混合,其质量分数大于4x%,此溶质可能是( )
| A. | H2SO4 | B. | NH3•H2O | C. | NaOH | D. | 乙醇 |
17.下列事实中能说明亚硝酸是弱电解质的是( )
| A. | 用HNO2溶液做导电试验,灯光较暗 | |
| B. | HNO2是共价化合物 | |
| C. | 亚硝酸不与氯化钠反应 | |
| D. | 常温下0.1mol/L亚硝酸溶液的氢离子约为0.01mol/L |
14.某温度下,浓度都是1mol•L-1的两种气体X2和Y2,在密闭容器中反应生成气体Z,经过t min后,测得物质的浓度分别为:[X2]=0.4mol•L-1,[Y2]=0.8mol•L-1,[Z]=0.4mol•L-1,则该反应的反应式可表示为( )
| A. | X2+2Y2?2XY2 | B. | 2X2+Y2?X2Y | C. | 3X2+Y2?2X3Y | D. | X2+3Y2?2XY3 |
15.在Cu2S+2Cu2O=6Cu+SO2↑反应中(注:Cu2S 和 Cu2O中,Cu为+1价),下列说法正确的是( )
| A. | 生成1molCu,转移2mol电子 | B. | Cu是氧化产物 | ||
| C. | Cu2S既是氧化剂又是还原剂 | D. | 氧化剂只有Cu2O |