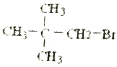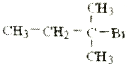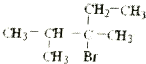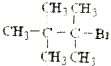题目内容
17.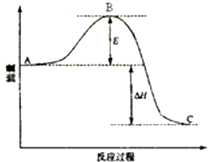 对于反应2SO2(g)+O2(g)?2SO3(g),反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3(g)的△H=-99kJ•mol-1.
对于反应2SO2(g)+O2(g)?2SO3(g),反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3(g)的△H=-99kJ•mol-1.(1)图中△H=-198kJ•mol-1;
(2)如果反应速率v(SO2)为0.05mol•L-1•min-1,则v(O2)=0.025mol•L-1•min-1,v(SO3)=0.05 mol•L-1•min-1;
(3)已知单质硫的燃烧热为296kJ•mol-1,计算由S(s)生成3mol SO3(g)的△H=-1185 kJ•mol-1.
分析 (1)根据参加反应SO2的物质的量之比等于对应的△H之比;
(2)根据反应速率之比等于系数之比计算;
(3)根据单质硫的燃烧热以及1mol SO2(g)氧化为1mol SO3的反应热利用盖斯定律来求.
解答 解:(1)因1mol SO2(g)氧化为1mol SO3的△H=-99kJ•mol-1,所以2molSO2(g)氧化为2molSO3的△H=-198kJ•mol-1,则2SO2(g)+O2(g)=2SO3(g)△H=-198KJ•mol-1,
故答案为:-198;
(2)反应的化学方程式为:2SO2(g)+O2(g)?2SO3(g),反应速率之比等于系数之比,v(SO2):v(O2):v(SO3)=2:1:2,反应速率υ(SO2)为0.05mol•L-1•min-1,依据比例计算得到v(O2)=0.025mol/L•min;v(SO3)=0.05mol•L-1•min-1,
故答案为:0.025;0.05;
(3)因单质硫的燃烧热为296kJ•mol-1,则S(s)+O2(g)=SO2(g)△H=-296kJ•mol-1,
而 1mol SO2(g)氧化为1mol SO3的△H=-99kJ•mol-1,则SO2(g)+$\frac{1}{2}$O2(g)=SO3(g)△H=-99kJ•mol-1,
由盖斯定律可得:S(s)+$\frac{3}{2}$O2(g)=SO3(g)△H=-296kJ•mol-1+(-99kJ•mol-1)=-395kJ•mol-1,
所以S(s)生成3mol SO3(g)的△H为-395kJ•mol-1×3=-1185 kJ•mol-1,
故答案为:-1185 kJ•mol-1.
点评 本题综合考查反应热与焓变,为高考常见题型,侧重于学生的分析能力和计算能力的考查,注意盖斯定律的应用.

 阅读快车系列答案
阅读快车系列答案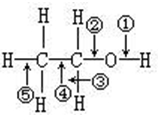 乙醇分子中各种化学键如图所示.下列有关反应断键位置说明错误的是( )
乙醇分子中各种化学键如图所示.下列有关反应断键位置说明错误的是( )| A. | 乙醇和浓硫酸,共热到140℃时断键①④ | |
| B. | 乙醇和金属钠的反应断键① | |
| C. | 乙醇和浓硫酸,共热到170℃时断键②⑤ | |
| D. | 乙醇在Cu或Ag催化下与O2反应时断键②③ |
①甲酸铵 ②甲酸甲酯 ③苯甲酸甲酯 ④葡萄糖 ⑤蔗糖 ⑥麦芽糖.
| A. | ①②④⑥ | B. | ①②⑥ | C. | ③④⑤ | D. | ①②⑤ |
| A. | 乙醇的结构简式为:CH2CH2OH | B. | 乙烯的实验式为:CH2 | ||
| C. | 甲基的电子式为: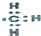 | D. | 三硝基甲苯的结构简式为: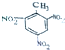 |
| A. | v(D)=0.3 mol•L-1•s-1 | B. | v (C)=0.4 mol•L-1•s-1 | ||
| C. | v (B)=0.6 mol•L-1•s-1 | D. | v (A)=0.25 mol•L-1•s-1 |
| A. | A(g)+2B(g)?2C(g)△H1>0 | B. | A(g)+B(g)?C(g)+D(g)△H2>0 | ||
| C. | A(s)+2B(g)?C(g)△H3>0 | D. | A(s)?B(g)+C(g)△H<0 |
| A. | 55.2kJ | B. | 391kJ | C. | 336kJ | D. | 1.38kJ |
| A. | 胶体中分散质粒子的直径小于1 nm | |
| B. | 胶体是一种介稳体系 | |
| C. | 用滤纸能分离胶体和悬浊液 | |
| D. | 利用丁达尔效应可以区分溶液和胶体 |