题目内容
6.用50mL 0.50mol•L-1盐酸和50mL 0.55mol•L-1 NaOH溶液反应,实验中测得起始温度为(20.1℃,终止温度为23.4℃,反应后溶液的比热容为4.18J•g-1•℃-1,盐酸和NaOH溶液的密度都近似认为是1g•cm-3,则中和反应生成1mol水时放热( )| A. | 55.2kJ | B. | 391kJ | C. | 336kJ | D. | 1.38kJ |
分析 先根据Q=m•c•△T计算反应放出的热量,然后根据△H=-$\frac{Q}{n}$kJ/mol计算出中和热.
解答 解:50mL 0.55mol•L-1 NaOH与50mL 0.5mol•L-1HCl进行中和反应生成水的物质的量为0.05L×0.50mol=0.025mol,
溶液的质量为:100ml×1g/cm3=100g,温度变化的值△T=23.4℃-20.1℃=3.3℃,则生成0.025mol水放出的热量为Q=m•c•△T=100g×4.18J/(g•℃)×3.3℃=1379.4J=1.3794KJ,所以实验测得的中和热△H=-$\frac{1.3794KJ}{0.025mol}$kJ/mol=-55.2kJ/mol,故中和反应生成1mol水放热55.2KJ.
故选A.
点评 本题考查学生有关中和热的测定知识,题目难度不大,注意掌握中和热的计算方法,明确中和热与酸、碱的物质的量无关.

练习册系列答案
相关题目
16.下列有机物的名称肯定错误的是( )
| A. | 2-甲基-1-丁烯 | B. | 2,2-二甲基完烷 | ||
| C. | 4-甲基-2-戊炔 | D. | 5,5-二甲基-3-己烯 |
14.下列物质沸点最高的是( )
| A. | 乙烷 | B. | 丙烷 | C. | 正戊烷 | D. | 异戊烷 |
1.羟基扁桃酸是药物合成的重要中间体,它可由苯酚和乙醛酸反应制得.
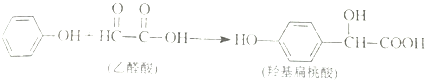
下列有关说法正确的是( )

下列有关说法正确的是( )
| A. | 该反应是加成反应 | |
| B. | 苯酚和羟基扁桃酸互为同系物 | |
| C. | 羟基扁桃酸的核磁共振氢谱上共有8个峰 | |
| D. | 1mol羟基扁桃酸能与3molNaOH反应 |
18.盛放烧碱试剂瓶的标签上应印有下列警示标记中的( )
| A. | 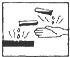 | B. |  | C. |  | D. |  |
15.若NA表示阿伏加德罗常数,下列说法中,正确的是( )
| A. | 1molCl2作为氧化剂得到的电子数为NA | |
| B. | 在0℃,101kPa时,22.4L氢气中含有NA个氢原子 | |
| C. | 25℃,1.01×105Pa,64g SO2中含有的原子数为3 NA | |
| D. | NA个一氧化碳分子和0.5mol甲烷的质量比为7:4 |
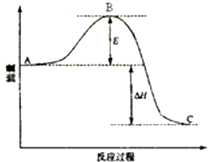 对于反应2SO2(g)+O2(g)?2SO3(g),反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3(g)的△H=-99kJ•mol-1.
对于反应2SO2(g)+O2(g)?2SO3(g),反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3(g)的△H=-99kJ•mol-1.