题目内容
8.下列说法不正确的是( )| A. | 对处于平衡状态的2HI(g)?H2(g)+I2(g)反应,缩小体积后混合物颜色变深 | |
| B. | 在恒温时,一固定容积的容器内发生如下反应:2NO2(g)?N2O4(g)达平衡时,再向容器内通入一定量的NO2(g),重新达到平衡后,与第一次平衡时相比,NO2的体积分数减小 | |
| C. | 对于可逆反应FeCl3(aq)+3KSCN(aq)?Fe(SCN)3(aq)+3KCl(aq)达到平衡后,向反应体系中加入KCl固体,平衡向逆反应方向移动 | |
| D. | 合成氨时适当增大压强有利于提高氢气的转化率 |
分析 A、缩小体积,平衡不发生移动,但体积减小,混合物颜色变深;
B、假设再次通入的NO2是在与原平衡体系的温度和压强都相同的另一容器中进行,则所得平衡体系与原平衡完全相同,将两个容器的隔板抽去,再压缩到原体积,平衡正向移动,以此解答;
C、氯离子不参与反应;
D、合成氨时适当增大压强,平衡向正反应分析移动.
解答 解:A.该反应为气体体积不变的反应,则缩小体积,平衡不发生移动,但体积减小,混合物颜色变深,故A正确;
B.假设在题给的过程中,容器的体积从A变化到A+B(见图) ,这个过程也可以理解成:假设有一个虚拟的隔板可以保持A的体积不变,在B中充入NO2,使其反应直至达到平衡.很明显,在同温、同压下,A、B中达到平衡后,NO2、N2O4的质量分数分别相等.这时,抽去虚拟的隔板,将B压缩至A,平衡正向移动,NO2的体积分数减小,故B正确;
,这个过程也可以理解成:假设有一个虚拟的隔板可以保持A的体积不变,在B中充入NO2,使其反应直至达到平衡.很明显,在同温、同压下,A、B中达到平衡后,NO2、N2O4的质量分数分别相等.这时,抽去虚拟的隔板,将B压缩至A,平衡正向移动,NO2的体积分数减小,故B正确;
C.氯离子不参与反应,平衡不移动,故C错误;
D.合成氨时适当增大压强,平衡向正反应分析移动,有利于提高氮气的转化率,故D正确.
故选C.
点评 本题考查了平衡移动原理,难度不大,注意使用勒夏特列原理的前提必须是可逆反应,易错点为B.

练习册系列答案
 快乐5加2金卷系列答案
快乐5加2金卷系列答案
相关题目
18.分类是化学学习中经常用到的方法,下列对一些物质或化学反应的分类以及依据正确的是( )
| A. | H2SO4是酸,因为H2SO4中含有氢元素 | |
| B. | 豆浆是胶体,因为豆浆中的分散质粒子直径在1nm~100nm之间 | |
| C. | Na和H2O的反应不是离子反应,因为反应中没有离子参加 | |
| D. | Na在Cl2中燃烧不是氧化还原反应,因为没有得氧或失氧 |
19.甲醚和乙醇互为同分异构体,其鉴别可采用化学方法或物理方法,也可以使用仪器鉴定法,下列鉴别方法,不能对二者进行区别的是( )
| A. | 加入金属钠 | B. | 利用质谱法 | ||
| C. | 利用红外光谱 | D. | 利用核磁共振氢谱仪 |
16.下列说法正确的是( )
| A. | 麦芽糖及其水解产物均能发生银镜反应 | |
| B. | 蛋白质水解的最终产物是多肽 | |
| C. | 乙烯和苯都能使溴水褪色,褪色的原因相同 | |
| D. | 石油裂解和油脂皂化都是由高分子生成小分子的过程 |
3.无色的有机物Ⅰ是印制防伪商标的一种原料,在紫外光辐射下Ⅰ可转变成结构Ⅱ(显橙色),反应如下(R1、R2、R3是烃基):有关上述变化的说法不正确的是( )
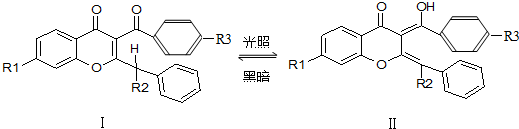

| A. | Ⅰ和Ⅱ互为同分异构体 | B. | Ⅱ可看作醇类 | ||
| C. | Ⅰ、Ⅱ均能发生加成反应 | D. | Ⅰ属于芳香烃 |
13.在20℃时,在一刚性容器内部有一个不漏气且可滑动的活塞将容器分隔成左右两室.左室充入氮气,右室充入氢气与氧气的混和气体,活塞恰好停留在离左端的1/5处(图1),然后引燃氢、氧混和气体,反应完毕后恢复至原来温度,活塞恰好停在中间(图2),如果忽略水蒸气体积,则反应前氢气与氧气的体积比可能是( )


| A. | 3:1 | B. | 4:5 | C. | 2:1 | D. | 3:2 |
20.x、y、z为三种元素的原子,已知x的阴离子与y、z的阳离子具有相同的电子层结构,且三种离子中z的阳离子半径最小,由此可知( )
| A. | 原子半径:x>y>z | B. | 电负性:x>z>y | ||
| C. | 原子序数:y>z>x | D. | 第一电离能:z>y>x |
10.相同温度和压强下,在容积为2L的密闭容器中发生反应:2HI(g)?H2(g)+I2(g),达到平衡状态的标志是( )
| A. | c(H2)保持不变 | |
| B. | c(H2)=c(I2) | |
| C. | 2v正(HI)=v逆(I2) | |
| D. | 拆开2 mol H-I共价键,同时生成1 mol H-H共价键 |
 ,沸点196.5℃.请回答下列问题:
,沸点196.5℃.请回答下列问题: 的沸点>196.5℃.(填“>”、“<”或“=”)原因是
的沸点>196.5℃.(填“>”、“<”或“=”)原因是