题目内容
【题目】氮化锶可做荧光粉的原料,可通过金属锶与干燥纯净的氮气在460℃时反应制得。锶与镁、钙同主族,能与水、NH3反应。实验室设计以下装置来制备氮化锶(夹持装置略去)。
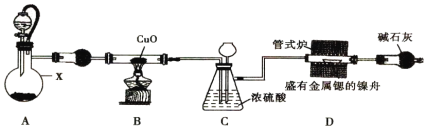
(1)实验简单步骤如下:①连接装置,检验装置的气密性②加装实验药品③点燃B处的酒精灯④加热D处的管式炉⑤打开A处的分液漏斗活塞。正确的实验操作步骤是________。
(2)仪器X的名称是__________;装置A是制取氨气的简易装置,仪器X中的固体是______________。
(3)装置B中的化学方程式是____________________。
(4)装置C的作用是平衡装置中的压强和____________________。
(5)装置D中的固体物质中含有氮化锶,已知氮化锶极易与水反应生成微溶于水的氢氧化锶,写出反应的化学方程式_________________________。
(6)锶的金属性比钠强,但锶与水反应的剧烈程度不如钠,原因足锶的熔点比钠高和____________________________。
【答案】①②⑤③④ 蒸馏烧瓶 CaO(或“碱石灰”、“NaOH”) 2NH3+3CuO![]() 3Cu+N2↑+3H2O 除去氮气中的氨和水 Sr3N2+6H2O=3Sr(OH)2+2NH3↑ 锶与水反应生成的微溶物氢氧化锶覆盖在锶的表面,缓和了金属与水的反应
3Cu+N2↑+3H2O 除去氮气中的氨和水 Sr3N2+6H2O=3Sr(OH)2+2NH3↑ 锶与水反应生成的微溶物氢氧化锶覆盖在锶的表面,缓和了金属与水的反应
【解析】
装置A是制取氨气的简易装置,用浓氨水分解制备氨气,常用溶于水大量放热的CaO或“碱石灰”、“NaOH”等物质,氨气经过球形干燥器后,经过灼热的氧化铜,发生氧化还原反应生成氮气,装置C中浓硫酸吸收反应生成的水,长颈漏斗平衡大气压,防止倒吸,最后纯净的氮气进入管式炉中制备氮化锶。
(1)正确的实验操作步骤是简单步骤如下:①连接装置,检验装置的气密性②加装实验药品⑤打开A处的分液漏斗活塞③点燃B处的酒精灯④加热D处的管式炉。
(2)仪器X的名称是蒸馏烧瓶;装置A是制取氨气的简易装置用浓氨水分解制备氨气,常用溶于水大量放热的CaO或“碱石灰”、“NaOH”等物质。
(3)根据氧化还原反应,装置B中的化学方程式是2NH3+3CuO![]() 3Cu+N2↑+3H2O。
3Cu+N2↑+3H2O。
(4)装置B可通过导管的产物为水、氨气,氨气极易溶于水,必须防止倒吸,浓硫酸吸收反应生成的水,长颈漏斗平衡大气压,故装置C的作用是平衡装置中的压强和除去氮气中的氨和水。
(5)氮化锶极易与水反应生成微溶于水的氢氧化锶,根据氧化还原反应原理,反应的化学方程式Sr3N2+6H2O=3Sr(OH)2+2NH3↑。
(6)锶的金属性比钠强,但锶与水反应的剧烈程度不如钠,原因足锶的熔点比钠高和锶与水反应生成的微溶物氢氧化锶覆盖在锶的表面,缓和了金属与水的反应。

【题目】将NaOH和碳酸氢钠的固体混合物20.8 g在密闭容器中加热到约250 ℃,经充分反应后排出气体,冷却,称得剩余固体的质量为15.9 g。试计算原混合物中氢氧化钠的质量分数_________?
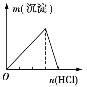
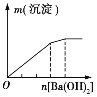
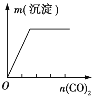
【题目】下列实验与图象对应的是
选项 | A | B | C | D |
实验 | NaAlO2溶液中逐滴滴加盐酸至过量 | AlCl3溶液中逐滴滴加氨水至过量 | 明矾溶液中逐滴滴加Ba(OH)2溶液至过量 | 澄清石灰水中缓慢通入CO2至过量 |
图象 |
|
|
|
|
A. AB. BC. CD. D