题目内容
3.焦亚硫酸钠(Na2S2O5)是常用的食品抗氧化剂之一.某研究小组进行如下实验:采用如图1装置(实验前已除尽装置内的空气)制取Na2S2O5.已知:①装置Ⅱ中有Na2S2O5晶体析出,发生的反应为Na2SO3+SO2═Na2S2O5.
②Na2S2O5晶体在空气中被氧化生成Na2SO4.
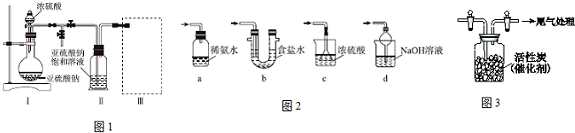
(1)装置Ⅰ中产生气体的化学方程式为Na2SO3+H2SO4═Na2SO4+SO2↑+H2O.
(2)要从装置Ⅱ中获得已析出的晶体,可采取的分离方法是过滤.
(3)装置Ⅲ用于处理尾气,可选用的最合理装置(图2)(夹持仪器已略去)为d(填序号).
(4)检测Na2S2O5晶体在空气中已被氧化的实验方案是取少量Na2S2O5晶体于试管中,加适量水溶解,滴加足量盐酸,振荡,再滴入氯化钡溶液,有白色沉淀生成.
(5)为了研究干燥的Cl2与干燥SO2反应及进行程度.用如图3所示装置收集满干燥的Cl2,再通入干燥SO2,集气瓶中立即产生无色液体SO2Cl2,充分反应后,将液体和剩余气体分离.继续用NaOH溶液吸收分离出的气体,用足量稀盐酸酸化后,再滴加BaCl2溶液,产生白色沉淀,该白色沉淀是白色沉淀是BaSO4,由此可知反应后剩余气必然存在混合气体中必然存在SO2和Cl2两种气体气体,综合实验信息,请写出干燥的SO2与Cl2反应的化学方程式SO2+Cl2$\stackrel{活性炭}{?}$SO2Cl2.
分析 本题是制取Na2S2O5的实验探究,考查了反应制备原理、反应混合物的分离及尾气处理,因Na2S2O5晶体在空气中被氧化生成Na2SO4,利用SO42-的检验来分析有没有变质,另外还考查了SO2和Cl2反应原理的探究,只要根据氧化还原反应及质量守恒及可解决相关问题;
(1)由装置Ⅱ中发生的反应可知,装置Ⅰ中产生的气体为SO2,亚硫酸钠与硫酸反应生成硫酸钠、二氧化硫与水;
(2)装置Ⅱ中获得已析出的晶体,分离固体与液态,应采取过滤操作;
(3)装置Ⅲ用于处理尾气,吸收为反应的二氧化硫,应防止倒吸,且不能处于完全密闭环境中;
(4)Na2S2O5晶体在空气中易被氧化为Na2SO4,用盐酸、氯化钡溶液检验样品中是否含有硫酸根即可;
(5)用NaOH溶液吸收分离出的气体,所得混合液用足量稀盐酸酸化后,再滴加BaCl2溶液,产生白色沉淀,可知原溶液里有SO42,得到的白色沉淀为BaSO4,结合单一SO2或Cl2和混合气体通入NaOH溶液的情况分析,可推测混合气体的成份.
解答 解:(1)由装置Ⅱ中发生的反应可知,装置Ⅰ中产生的气体为SO2,亚硫酸钠与硫酸反应生成硫酸钠、二氧化硫与水,反应方程式为:Na2SO3+H2SO4=Na2SO4+SO2↑+H2O,
故答案为:Na2SO3+H2SO4=Na2SO4+SO2↑+H2O;
(2)装置Ⅱ中获得已析出的晶体,分离固体与液态,应采取过滤进行分离,
故答案为:过滤;
(3)a.装置应将导管深入氨水中可以吸收二氧化硫,但为密闭环境,装置内压强增大易产生安全事故,故错误;
b.该装置吸收二氧化硫能力较差,且为密闭环境,装置内压强增大易产生安全事故,故错误;
c.该装置不能吸收二氧化硫,所以无法实现实验目的,故错误;
d.该装置中氢氧化钠与二氧化硫反应,可以吸收,且防止倒吸,故正确;
故答案为:d;
(4)Na2S2O5中S元素的化合价为+4价,因此会被氧化为为+6价,即晶体在空气中易被氧化为Na2SO4,用盐酸、氯化钡溶液检验样品中是否含有硫酸根即可,实验方案为:取少量Na2S2O5晶体于试管中,加入适量水溶解,滴加盐酸,振荡,再滴加氯化钡溶液,有白色沉淀生成,
故答案为:取少量Na2S2O5晶体于试管中,加入适量水溶解,滴加盐酸,振荡,再滴加氯化钡溶液,有白色沉淀生成;
(5)生成的白色沉淀为BaSO4,说明NaOH溶液吸收分离出的气体成分不是单一的SO2或Cl2,而是二者的混合气体,在水溶液里发生了氧化还原反应,生成了硫酸根离子,同时也可知SO2与Cl2生成SO2Cl2的反应是可逆反应,因为反应物的转化率没有达到100%,故答案为:白色沉淀是BaSO4;混合气体中必然存在SO2和Cl2两种气体;SO2+Cl2$\stackrel{活性炭}{?}$SO2Cl2.
点评 本题考查物质的制备实验、实验方案设计、物质含量的测定、氧化还原反应滴定等,难度中等,明确实验原理是解本题关键,根据物质的性质分析解答,注意元素化合物知识的积累和灵活运用

 口算题天天练系列答案
口算题天天练系列答案| A. | 配制一定物质的量浓度的NaCl溶液定容时,俯视会使溶液浓度偏大 | |
| B. | 除去氯气中HCl用饱和食盐水 | |
| C. | 海水开发用的部分过程如图:工业生产中常选用NaOH作为沉淀剂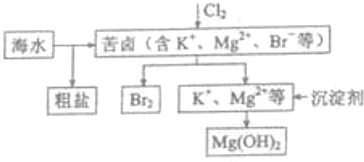 | |
| D. | 富集溴一般先用空气和水蒸气吹出单质溴,再用SO2将其还原吸收 |
| A. | 用碳酸钠溶液吸收少量二氧化硫:2CO32-+SO2+H2O═2HCO3-+SO32- | |
| B. | 向碳酸氢钠溶液中加入氢氧化钠:HCO3-+OH-═CO2↑+H2O | |
| C. | 向FeCl3溶液中加入铜片:Fe3++Cu═Fe2++Cu2+ | |
| D. | 向NaHSO4溶液中滴加过量Ba(OH)2溶液:2H++SO42-+Ba2++2OH-═BaSO4↓+2H2O |
| A. | 常温常压下,氯气呈气态而溴单质呈液态 | |
| B. | 硝酸是挥发性酸,硫酸是难挥发性的酸 | |
| C. | 稀有气体一般难发生化学反应 | |
| D. | 氮气在常温下很稳定,化学性质不活泼 |
| 选项 | 实验内容 | 结论 |
| A | 某物质的水溶液能使红色石蕊试纸变蓝 | 该物质一定是氨气 |
| B | 某物质的水溶液中加入盐酸产生无色无味气体 | 该溶液一定含有大量碳酸根离子 |
| C | 测定同浓度Na2CO3 和Na2SO4 溶液的pH,前者大于后者 | 碳元素非金属性弱于硫 |
| D | 向沸水中逐滴加入1~2mL FeCl3饱和溶液,搅拌并继续煮沸出现浑浊 | 制备Fe(OH)3胶体 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 1molN2+3molH2 | B. | 2molNH3+1molHe | ||
| C. | 2molN2+3molH2 | D. | 0.1molNH3+0.95molN2+2.85molH2 |
| A. | NaOH溶液 | B. | 盐酸 | C. | NH4SCN溶液 | D. | KSCN溶液 |
