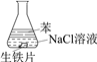题目内容
【题目】下列实验不能达到目的的是
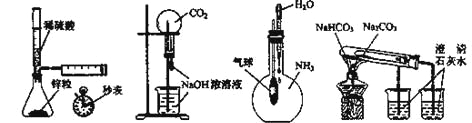
A B C D
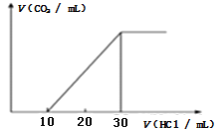
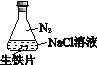
A. 测定一定时间内生成H2的反应速率B. 用CO2做喷泉实验
C. 验证NH3易溶于水D. 比较Na2CO3和NaHCO3的热稳定性
【答案】D
【解析】
A、根据产生氢气的体积和时间可以测定一定时间内生成H2的反应速率,故A正确;
B、CO2与挤入的NaOH溶液反应,使圆底烧瓶内气体压强减小,产生压强差,使烧杯里的NaOH溶液通过导管被压入圆底烧瓶内,与剩下的二氧化碳继续反应,进一步产生压强差形成喷泉,故B正确;
C、滴入水后,NH3易溶于水,使烧瓶内的气压变小,在大气压的作用下,外面的空气进入到气球中,气球胀大,故C正确;
D、要比较碳酸钠和碳酸氢钠的热稳定性,应该在小试管中盛放碳酸氢钠,故D错误;
答案选D。

练习册系列答案
 期末好成绩系列答案
期末好成绩系列答案 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案
相关题目
【题目】研究生铁的锈蚀,下列分析不正确的是
序号 | ① | ② | ③ |
实验 |
|
|
|
现象 | 8小时未观察 到明显锈蚀 | 8小时未观察 到明显锈蚀 | 1小时观察 到明显锈蚀 |
A. ①中,NaCl溶液中溶解的O2不足以使生铁片明显锈蚀
B. ②中,生铁片未明显锈蚀的原因之一是缺少H2O
C. ③中正极反应:O2+4e+ 2H2O ==4OH
D. 对比①②③,说明苯能隔绝O2