题目内容
【题目】回答下列问题:(1)下列物质中 ①Cu ②液态SO2 ③CH3COOH ④NaHCO3 ⑤Ba(OH)2溶液 ⑥熔融NaCl ⑦稀氨水 ⑧BaSO4 ⑨H2O。属于强电解质的是_________(填序号),属于弱电解质的是 ________(填序号);
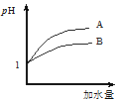
(2)25 ℃时,向pH均为1的盐酸和醋酸溶液中分别加水,随加水量的增多,两溶液pH的变化如图所示,则符合盐酸pH变化的曲线是________;
(3)现有25℃、pH=13的Ba(OH)2溶液,与某浓度盐酸溶液按体积比(碱与酸之比)1:9混合后,所得溶液pH=11(假设混合溶液的体积等于混合前两溶液的体积和),该盐酸溶液的pH=__________.
【答案】 ④⑥⑧ ③⑨ A 2
【解析】(1)①Cu 是单质既不是电解质也不是非电解质;②液态SO2属于非金属氧化物,是非电解质;③CH3COOH是弱酸,在水溶液中或熔融状态下能部分电离,为弱电解质;④NaHCO3 属于盐,在水溶液中或熔融状态下能完全电离,为强电解质;⑤Ba(OH)2溶液属于混合物,既不是电解质也不是非电解质;⑥熔融NaCl属于盐,在水溶液中或熔融状态下能完全电离,为强电解质;⑦稀氨水属于混合物,既不是电解质也不是非电解质;⑧BaSO4 属于盐,在水溶液中或熔融状态下能完全电离,为强电解质;⑨H2O能够部分电离产生自由移动的离子,属于弱电解质;属于强电解质的是:④⑥⑧;属于弱电解质的是:③⑨;故答案为:④⑥⑧;③⑨;
(2)pH相等的醋酸和盐酸中,加水稀释促进醋酸电离,导致稀释相同的倍数时,醋酸溶液的酸性比盐酸强,醋酸的pH小于HCl,根据图象知,A是HCl变化曲线,故选A;
(3)设盐酸的物质的量浓度为:c(HCl),碱与酸体积分别为1L、9L,则n(OH -)=0.1mol/L×1L=0.1mol,n(H+)=c(HCl)×9L,反应后剩余氢氧根离子的物质的量为:0.1mol-c(HCl)×9L;由混合所得溶液pH=11可知,混合后c(H+)=10-11 molL-1,则混合后c(OH -)=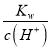 =10-3 molL-1,所以
=10-3 molL-1,所以![]() =10-3 molL-1,解得:c(HCl)=10-2molL-1,pH=-lg c(H+),所以pH=2,故答案为:2。
=10-3 molL-1,解得:c(HCl)=10-2molL-1,pH=-lg c(H+),所以pH=2,故答案为:2。

 品学双优卷系列答案
品学双优卷系列答案 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案 期末复习检测系列答案
期末复习检测系列答案 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案