题目内容
【题目】向含Fe2+、I﹣、Br﹣的溶液中通入过量的氯气,溶液中四种粒子的物质的量变化如图所示,已知b﹣a=5,线段Ⅳ表示一种含氧酸,且Ⅰ和Ⅳ表示的物质中含有相同的元素.下列说法正确的是( )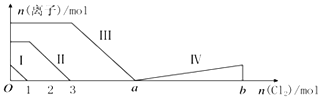
A.线段Ⅱ表示Br﹣的变化情况
B.线段Ⅳ表示IO3﹣的变化情况,其中IO3﹣增加了5moL.
C.a=6
D.原溶液中n(FeI2):n(FeBr2)=3:1
【答案】C
【解析】解:A.根据分析可知,线段Ⅱ为亚铁离子被氯气氧化为铁离子,反应的离子方程式为:2Fe2++Cl2=2Fe3++2Cl﹣ , 不是氧化溴离子,故A错误;
B.线段IV表示一种含氧酸,且I和IV表示的物质中含有相同的元素,该元素为I元素,a﹣b段I2被Cl2氧化,已知碘单质的物质的量为1mol,反应消耗氯气的物质的量为b﹣a=5mol,根据电子守恒,则该含氧酸中碘元素的化合价为: ![]() =+5价,则该含氧酸为HIO3 , 即:线段Ⅳ表示IO3﹣的变化情况,IO3﹣增加了2moL,故B错误;
=+5价,则该含氧酸为HIO3 , 即:线段Ⅳ表示IO3﹣的变化情况,IO3﹣增加了2moL,故B错误;
C.由分析可知,溶液中n(Br﹣)=2n(Fe2+)﹣n(I﹣)=2×4mol﹣2mol=6mol,根据2Br﹣+Cl2=Br2+2Cl﹣可知,溴离子反应需要氯气的物质的量为3mol,故a=3+3=6,故C正确;
D.n(FeI2):n(FeBr2)=n(I﹣):n(Br﹣)=2mol:6mol=1:3,故D错误;
故选C.

练习册系列答案
 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案
相关题目