题目内容
【题目】在金属冶炼产生的废弃物中,常含有砷元素(与磷同主族),由于有毒需检测与处理。
Ⅰ.冶炼废水中砷元素主要以亚砷酸(H3AsO3)形式存在,可用化学沉降法处理酸性高浓度含砷废水,其工艺流程如下:
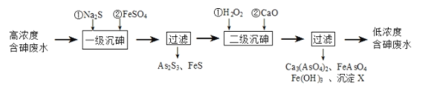
已知:①As2S3与过量的S2-存在以下反应:As2S3(s)+3S2-(aq)![]() 2AsS33-(aq);
2AsS33-(aq);
②亚砷酸盐的溶解性大于相应砷酸盐。
(1)亚砷酸中砷元素的化合价为___;砷酸的第一步电离方程式为__。
(2)“一级沉砷”中FeSO4的作用是___。
(3)“二级沉砷”中H2O2与含砷物质反应的化学方程式为___。沉淀X为___(填化学式)。
Ⅱ.强阴离子交换柱可以吸附以阴离子形态存在的As(V)达到去除As的目的。采用该方法去除水体中的砷时,可选用NaClO将As(Ⅲ)转化为As(V)。
已知:一定条件下,As(V)的存在形式如表所示:
pH | <2 | 2~7 | 7~11 | 11~14 |
存在形式 | H3AsO4 | H2AsO4 | HAsO42 | HAsO42、AsO43 |
(4)pH=6时,NaClO氧化亚砷酸(H3AsO3)的离子方程式是___。
Ⅲ.冶炼废渣中的砷元素主要以As2S3的形式存在,可用古氏试砷法半定量检测(As的最低检出限为3.0×10-6g)。
步骤1:取10g废渣样品,粉碎后与锌粉混合,加入H2SO4共热,生成AsH3气体。
步骤2:将AsH3气体通入AgNO3溶液中,生成银镜和As2O3。
步骤3:取1g废渣样品,重复上述实验,未见银镜生成(即未能检出)。
(5)请写出步骤2的离子方程式____。
【答案】+3 H3AsO4![]() H++H2AsO4- 沉淀过量的S2-,使As2S3(s)+3S2-(aq)
H++H2AsO4- 沉淀过量的S2-,使As2S3(s)+3S2-(aq)![]() 2AsS33-(aq)平衡左移,提高沉砷效果 H3AsO3+H2O2=H3AsO4+H2O CaSO4 ClO-+ H3AsO3=H2AsO4+Cl-+H+ 2AsH3+12Ag++3H2O=12Ag+As2O3+12H+
2AsS33-(aq)平衡左移,提高沉砷效果 H3AsO3+H2O2=H3AsO4+H2O CaSO4 ClO-+ H3AsO3=H2AsO4+Cl-+H+ 2AsH3+12Ag++3H2O=12Ag+As2O3+12H+
【解析】
Ⅰ.(1)H为+1价,O为-2价,依据化合物中各元素的化合价的代数和为0,可求出As元素的化合价;在第ⅤA族非金属元素形成最高价含氧酸中,磷、砷形成的含氧酸都是弱酸,在水溶液中分步电离。
(2)高浓度含砷废水中加入Na2S后,发生反应As2S3+3S2-2AsS32-,为提高除砷效果,需将产物再次转化为As2S3,加入FeSO4就是为了达到使平衡逆向移动的目的。
(3)“二级沉砷”中H2O2与含砷物质反应,将亚砷酸氧化为砷酸,自身被还原为水。加入氧化钙和水反应生成氢氧化钙,氢氧化钙和砷酸反应生成砷酸钙沉淀,与铁离子反应生成氢氧化铁沉淀,钙离子结合硫酸根离子形成硫酸钙沉淀
(4)pH=6时,NaClO氧化亚砷酸(H3AsO3)生成H2AsO4,ClO-被还原为Cl-。
(5)在酸性环境中,将AsH3气体通入AgNO3溶液中,生成银镜和As2O3,则反应物为AsH3和Ag+,生成物为Ag、As2O3等。
Ⅰ.(1)亚砷酸(H3AsO3)中氢元素+1价,氧元素-2价,化合物中各元素化合价代数和为0,则砷元素的化合价为+3价,第ⅤA族非金属元素形成最高价含氧酸中磷、砷形成的含氧酸都是弱酸,在水溶液中分步电离,电离方程式为:H3AsO4H++H2AsO4-,故答案为:+3;H3AsO4![]() H++H2AsO4-;
H++H2AsO4-;
(2)“一级沉砷”中FeSO4的作用是除去过量的硫离子,As2S3+3S2-2AsS32-使平衡逆向进行,提高沉砷效果,“二级沉砷”中H2O2与含砷物质发生氧化还原反应,氧化亚砷酸为砷酸;反应的化学方程式为:H2AsO3+H2O2=H3AsO4+H2O;答案为:沉淀过量的S2-,使As2S3(s)+3S2-(aq)![]() 2AsS33-(aq)平衡左移,提高沉砷效果;H3AsO3+H2O2=H3AsO4+H2O。
2AsS33-(aq)平衡左移,提高沉砷效果;H3AsO3+H2O2=H3AsO4+H2O。
(3)流程分析可知,加入氧化钙和水反应生成氢氧化钙,氢氧化钙和砷酸反应生成砷酸钙沉淀,与铁离子反应生成氢氧化铁沉淀,钙离子结合硫酸根离子形成硫酸钙沉淀,所以沉淀X为CaSO4;答案为:CaSO4。
(4)pH=6时,NaClO氧化亚砷酸(H3AsO3)生成H2AsO4,ClO-被还原为Cl-,反应的离子方程式为ClO-+ H3AsO3=H2AsO4+Cl-+H+;答案为:ClO-+ H3AsO3=H2AsO4+Cl-+H+。
(5)将AsH3气体通入AgNO3溶液中,生成银镜和As2O3,则反应物为AsH3和Ag+,生成物为Ag、As2O3等,溶液为酸性环境。反应的离子方程式为2AsH3+12Ag++3H2O=12Ag
+As2O3+12H+;答案为:2AsH3+12Ag++3H2O=12Ag+As2O3+12H+。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案