题目内容
【题目】对于Zn(s)+H2SO4(aq)===ZnSO4(aq)+H2(g) ΔH<0的化学反应下列叙述不正确的是
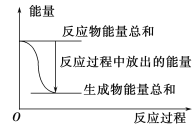
A. 反应过程中能量关系可用上图表示
B. ΔH的值与反应方程式的计量系数有关
C. 若将该反应设计成原电池,锌为负极
D. 若将其设计为原电池,当有32.5 g锌溶解时,正极放出气体一定为11.2 L
【答案】D
【解析】
对于Zn(s)+H2SO4(aq)=ZnSO4(aq)+H2(g) △H<0,反应为放热反应,说明反应物的总能量大于生成物的总能量,当将该反应设计为原电池时,Zn为负极,被氧化,正极上H+获得电子,析出氢气,以此解答该题。
A.反应为放热反应,说明反应物的总能量大于生成物的总能量,图示正确,选项A正确;
B.热化学方程式中,反应热与物质的物质的量呈正比,选项B正确;
C.反应中Zn被氧化生成ZnSO4,当将该反应设计为原电池时,Zn为负极,失去电子,被氧化,发生氧化反应,选项C正确;
D.若将其设计为原电池,当有32.5g锌溶解时,n(Zn)=32.5g÷65g/mol=0.5mol,n(e-)=2 n(Zn)=2×0.5mol=1mol,根据在同一闭合回路中电子转移数目相等,可知在正极放出气体的物质的量是n(H2)= 0.5mol,在标况下体积为V(H2)= 0.5mol×22.4L/mol= 11.2L,但由于未指明气体所处的环境,所以不能确定气体的体积,选项D错误;
故合理选项是D。

【题目】已知部分弱酸的电离平衡常数如表:
弱酸 | 醋酸 | 次氯酸 | 碳酸 | 亚硫酸 |
电离平衡常数(25℃) | Ka=1.75×10-5 | Ka=2.98×10-8 | Ka1=4.30×10-7 Ka2=5.61×10-11 | Ka1=1.54×10-2 Ka2=1.02×10-7 |
下列离子方程式正确的是( )
A.少量CO2通入NaClO溶液中:CO2+H2O+2ClO-═CO![]() +2HClO
+2HClO
B.少量SO2通入Ca(ClO)2溶液中:SO2+H2O+Ca2++2ClO-═CaSO3↓+2HClO
C.少量SO2通入Na2CO3溶液中:SO2+H2O+2CO![]() ═SO
═SO![]() +2HCO
+2HCO![]()
D.相同浓度NaHCO3溶液与醋酸溶液等体积混合:H++HCO![]() ═CO2↑+H2O
═CO2↑+H2O