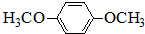
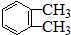
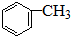
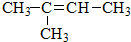题目内容
5.下列各组离子在指定的溶液中一定能大量共存的是( )| A. | 由水电离出的c (OH-)=10-13mol•L-1的溶液中:Na+、Ba2+、Cl-、Br- | |
| B. | c(H+)/c(OH-)=1012的溶液中:Fe2+、Al3+、NO3-、Cl- | |
| C. | 含大量Al3+的溶液中:K+、Na+、SO42-、AlO2- | |
| D. | 无色溶液中:K+、Na+、MnO4-、SO42- |
分析 A.由水电离出的c (OH-)=10-13mol•L-1的溶液,为酸或碱溶液;
B.c(H+)/c(OH-)=1012的溶液,显酸性;
C.离子之间相互促进水解;
D.MnO4-为紫色.
解答 解:A.由水电离出的c (OH-)=10-13mol•L-1的溶液,为酸或碱溶液,酸、碱溶液中该组离子之间均不反应,可大量共存,故A正确;
B.c(H+)/c(OH-)=1012的溶液,显酸性,Fe2+、H+、NO3-发生氧化还原反应,不能大量共存,故B错误;
C.Al3+、AlO2-相互促进水解,不能大量共存,故C错误;
D.MnO4-为紫色,与无色不符,故D错误;
故选A.
点评 本题考查离子的共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重氧化还原反应、水解反应及复分解反应的离子共存考查,注意常见离子的颜色,题目难度不大.

练习册系列答案
 教学练新同步练习系列答案
教学练新同步练习系列答案 课前课后同步练习系列答案
课前课后同步练习系列答案
相关题目
15.在一个密闭容器中有N2和H2,它们的起始浓度分别是1.8mol•L-1和5.4mol•L-1,在一定条件下反应生成NH3,10min后测得N2的浓度为0.8mol•L-1,则在这10min内N2的平均反应速率是( )
| A. | 0.1 mol•L-1•min-1 | B. | 0.2 mol•L-1•min-1 | ||
| C. | 0.3 mol•L-1•min-1 | D. | 0.6 mol•L-1•min-1 |
16.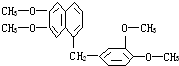 鸦片具有复杂的组成,其中所含罂粟碱分子结构如图,由其分子结构可推知下列关于罂粟碱的叙述中错误的是( )
鸦片具有复杂的组成,其中所含罂粟碱分子结构如图,由其分子结构可推知下列关于罂粟碱的叙述中错误的是( )
 鸦片具有复杂的组成,其中所含罂粟碱分子结构如图,由其分子结构可推知下列关于罂粟碱的叙述中错误的是( )
鸦片具有复杂的组成,其中所含罂粟碱分子结构如图,由其分子结构可推知下列关于罂粟碱的叙述中错误的是( )| A. | 其分子式为C21H22O4 | |
| B. | 罂粟碱属芳香酯类 | |
| C. | 1 mol罂粟碱完全燃烧需O2量24.5 mol | |
| D. | 其苯环氢的一溴取代物可有8种结构 |
20.下列分子式只能表示一种物质的是( )
| A. | C6H12O6 | B. | CH2O2 | C. | C2H6O | D. | C3H6 |
10.下列有关热化学方程式及其叙述正确的是( )
| A. | 氢气的燃烧热为285.8 kJ/mol,则水电解的热化学方程式为:2H2O(l)=2H2(g)+O2(g)△H=+285.8 kJ/mol | |
| B. | 1 mol甲烷完全燃烧生成CO2和H2O(l)时放出890kJ热量,则甲烷的燃烧热化学方程式为:$\frac{1}{2}$CH4(g)+O2(g)=$\frac{1}{2}$CO2 (g)+H2O(l)△H=-445 kJ/mol | |
| C. | HF与NaOH溶液反应:H+(aq)+OH-(aq)=H2O(l)△H=-57.3 kJ/mol | |
| D. | 由石墨比金刚石稳定可知:C(金刚石,s)=C(石墨,s)△H<0 |
15.配制250mL 2mol/L的稀盐酸,需要12.5mol/L的浓盐酸的体积为( )
| A. | 20mL | B. | 40mL | C. | 60mL | D. | 80mL |
 制取氨气并完成喷泉实验(图中夹持装置均已略去).
制取氨气并完成喷泉实验(图中夹持装置均已略去).