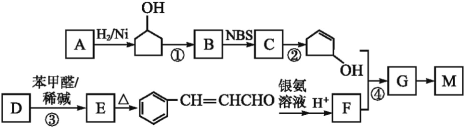
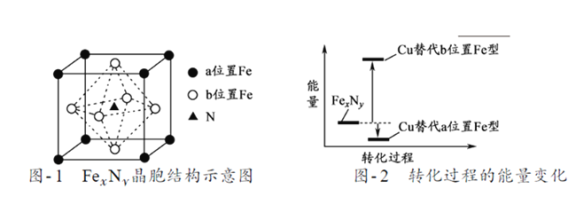
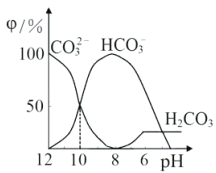
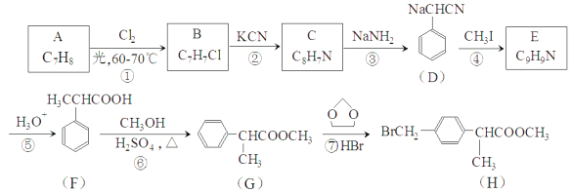
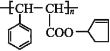题目内容
【题目】哈尔滨医科大学附属第一医院张亭栋教授被认为最有可能获诺贝尔生理学或医学奖的学者之一,他是使用砒霜(As2O3)治疗白血病的奠基人,回答下列问题:
(1)基态As原子核外电子排布中能级最高的是___________,与As同周期且相邻原子的第一电离能由大到小的顺序为___________。
(2)NH3的沸点比PH3___________(填“高”或“低”),原因是___________。
(3)NH5中所有原子最外层都满足稳定结构,则NH5中含有的化学键类型为___________。
A、离子键 B、配位键 C、共价键 D、氢键 E、σ键 F、π键
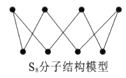
(4)As4O6的分子结构如图1所示,则该化合物中As的杂化方式是__________。与AsO43-互为等电子体的微粒是___________(写一种)
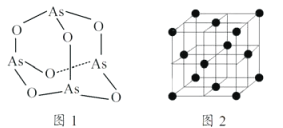
(5)白磷(P4)的晶体属于分子晶体,其晶胞结构如图2(小黑点表示白磷分子),已知晶胞的边长为anm,阿伏加德罗常数为 NAmol-1,则该晶胞中含有的P4分子数为___________,该晶体的密度为___________g·cm-3(用含NA、a的式子表示)。
【答案】4p As>Se>Ge 高 NH3分子间存在氢键 ABCE sp3 PO43-或SO42-或ClO4- 4 ![]()
【解析】
(1)根据构造原理,基态As原子核外电子排布中能级最高的是4p,As的4p能级处于半充满状态,第一电离能比相邻同期元素均大,与As同周期且相邻原子的第一电离能由大到小的顺序为As>Se>Ge。
(2)根据分子晶体影响沸点的因素分析;
(3)NH5是离子化合物,含有离子键和共价键,以此分析。
(4)根据杂化轨道理论判断中心As的杂化方式;原子总数和价电子总数相同的称为等电子体。
(5)根据均摊法可知,晶胞中P4分子数目为4,则晶胞中含有16个P原子,计算晶胞质量,再根据ρ=m/V计算晶胞密度。
(1)根据构造原理,基态As原子核外电子排布中能级最高的是4p,As的4p能级处于半充满状态,第一电离能比相邻同期元素均大,与As同周期且相邻原子的第一电离能由大到小的顺序为As>Se>Ge。
(2)NH3的沸点比PH3高,原因是NH3分子间存在氢键,相对分子质量对沸点的影响占次要地位。
(3)NH5中所有原子最外层都满足稳定结构,其中N与H形成共价键,是σ键,4个共价键中有一个是配位键,NH4+与H-之间形成离子键,则NH5中含有的化学键类型为A B C E 。
(4)价电子对数=3+(5-1×3)/2=4,VSEPR模型为四面体,所以其空间构型为正四面体,根据杂化轨道理论,中心As的杂化方式为sp3,原子总数和价电子总数相同的称为等电子体,与AsO43-互为等电子体的微粒是PO43-或SO42-或ClO4- ;
(5)根据均摊法可知,晶胞中P4分子数目为8×1/8+6×1/2=4,则晶胞中P原子数目为4×4=16,晶胞质量为16×31/NAg,晶胞体积为(a×10-7 cm)3,则晶胞密度为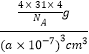 g·cm-3,即:
g·cm-3,即:![]() g·cm-3
g·cm-3